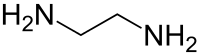
Ethylendiamin (nach IUPAC-Nomenklatur: Ethan-1,2-diamin, abgekürzt häufig als EDA bezeichnet) ist eine organisch-chemische Verbindung aus der Stoffgruppe der aliphatischen primären Amine. Genauer gesagt handelt es sich um ein Diamin.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Ethylendiamin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C2H8N2 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit ammoniakartigem Geruch[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 60,10 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||||||||
| Dichte |
0,90 g·cm−3 (20 °C)[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
116 °C[1] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| pKS-Wert |
6,90 (pKS1) bzw. 9,95 (pKS2) für das doppelt protonierte Molekül[2] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Brechungsindex |
1,4565 (20 °C)[4] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: ernsthafte Auswirkungen auf die menschliche Gesundheit gelten als wahrscheinlich[6] | |||||||||||||||||||||
| MAK | ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 |
−63,0 kJ/mol[8] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Gewinnung und Darstellung
BearbeitenZur großtechnischen Herstellung von Ethylendiamin existieren in der Chemischen Industrie mehrere Verfahren und Verfahrensvarianten.
Das heutzutage am häufigsten eingesetzte Verfahren zur Synthese von Ethylendiamin ist die Umsetzung von Monoethanolamin mit Ammoniak bei Temperaturen von 160–230 °C und Drücken von 150–250 bar in Gegenwart von Wasserstoff an Übergangsmetalloxid-Katalysatoren, die im Wesentlichen aus Nickel- und Kupferoxid sowie aus Zirconiumdioxid bestehen und auf Aluminiumoxid (Al2O3) geträgert sind, in der flüssigen Phase.[9]
Die Reaktion wird bevorzugt in Festbettreaktoren durchgeführt. Besonders gut geeignet sind Rohrreaktoren sowie Rohrbündelreaktoren, bei denen Salzschmelzen die gesamte Reaktion auf nahezu konstanter Temperatur halten. Bei diesem Verfahren entstehen neben Ethylendiamin Nebenprodukte wie Diethylentriamin (DETA) und Triethylentetramin (TETA), die durch mehrstufige destillative Aufarbeitung unter Druck abgetrennt werden. Bevorzugt kann statt Monoethanolamin auch Ethylenglycol eingesetzt werden. Dabei muss Ammoniak jedoch in zweifachem molaren Überschuss eingesetzt werden.[9]
Ein zweites großtechnisches Verfahren zur Herstellung von Ethylendiamin betrifft die Umsetzung von 1,2-Dichlorethan mit Ammoniak unter Druck bei 180 °C im wässrigen Medium. Als Katalysatoren werden ebenfalls Kupfer- oder Nickelkontakte, die als Festbett angeordnet sind, verwendet.[10]
Dabei bildet sich Chlorwasserstoff, der zunächst als Hydrochlorid des Amins in gebundener Form vorliegt. Das Amin wird durch Zugabe von Natriumhydroxid in seine freie Form überführt und kann anschließend durch Rektifikation aus dem Gemisch gewonnen werden. Als Nebenprodukte werden ebenfalls Diethylentriamin (DETA) und Triethylentetramin (TETA) gebildet.[10]
Eigenschaften
BearbeitenPhysikalische Eigenschaften
BearbeitenEthylendiamin hat eine relative Gasdichte von 2,07 (Dichteverhältnis zu trockener Luft bei gleicher Temperatur und gleichem Druck) und eine relative Dichte des Dampf-Luft-Gemisches von 1,01 (Dichteverhältnis zu trockener Luft bei 20 °C und Normaldruck). Die Dichte beträgt 0,90 g·cm−3 bei 20 °C. Außerdem weist Ethylendiamin einen Dampfdruck von 12,4 hPa bei 20 °C, 22,6 hPa bei 30 °C, 39,4 hPa bei 40 °C und 66,3 hPa bei 50 °C auf.[1]
Chemische Eigenschaften
BearbeitenEthan-1,2-diamin ist eine entzündbare Flüssigkeit aus der Stoffgruppe der aliphatischen primären Amine. Es ist vollständig mit Wasser mischbar und bildet dabei ein Hydrat. Die wässrigen Lösungen von Ethylendiamin reagieren stark basisch. Außerdem ist Diaminoethan hygroskopisch und raucht an feuchter Luft. Ethylendiamin gilt als mittel bis schwer flüchtig. Eine wässrige Lösung der Konzentration 100 g·l−1 weist bei 25 °C einen pH-Wert von 12,2 auf.
Verwendung
BearbeitenEthylendiamin findet in der Komplexchemie besonders Anwendung zur Synthese von Chelat-Bildnern (z. B. Ethylendiamintetraessigsäure). Des Weiteren wird es als Lösungsmittel, Stabilisator und zur Säureneutralisation in Ölen eingesetzt. Es findet auch bei der Herstellung von Kunstharzen, Kautschuk-Chemikalien, Arzneimitteln, Schädlingsbekämpfungsmitteln, Inhibitoren und Wasch- bzw. Reinigungsmitteln Verwendung. In der Organischen Chemie wird Ethylendiamin auch als Base zur Isomerisierung von Allylalkoholen in Aldehyde, zur Reduktion von Nitroarenen zu Azo-Verbindungen und vielen weiteren Reaktionen eingesetzt.[3] Ferner dient es als Zwischenprodukt in den Bereichen Korrosionsschutz, Polyamidharze und Schmierstoff- sowie Treibstoffadditive.[11]
Sicherheitshinweise
BearbeitenDie Dämpfe von Ethylendiamin können mit Luft beim Erhitzen über den Flammpunkt explosive Gemische bilden. Hauptsächlich wird Ethylendiamin über den Atemtrakt und die Haut aufgenommen. Dabei kommt es akut zu starken Reizwirkungen auf die Haut und der Schleimhäute bis hinzu Verätzungen. Des Weiteren wurde eine sensibilisierende Wirkung auf die Haut und die Atemwege festgestellt. Ethylendiamin hat außerdem starke Auswirkungen auf Blut, Nieren und Herz-Kreislaufsystem des Betroffenen. Chronisch kann es bei Aufnahme oder Resorption zu Atemwegsreizungen und Asthma-Erkrankungen kommen, dessen Hergang oft unbekannt ist. Außerdem können sich irritative und allergische Hauterkrankungen ausbilden. In Tierversuchen wurde eine Beeinflussung der Leber- und Nierenfunktion ermittelt. Eine Reproduktionstoxizität, Mutagenität oder Kanzerogenität konnte bisher noch nicht nachgewiesen werden. Ethylendiamin weist eine untere Explosionsgrenze von etwa 2,5 Vol.-% und eine obere Explosionsgrenze von etwa 16,3 Vol.-% auf. Die Zündtemperatur beträgt etwa 400 °C. Der Stoff fällt somit in die Temperaturklasse T2 und die Explosionsgruppe IIA. Die Grenzspaltweite wurde auf 1,25 mm ermittelt. Mit einem Flammpunkt von 34 °C gilt Ethylendiamin als entflammbar.[1]
Einzelnachweise
Bearbeiten- ↑ a b c d e f g h i j k l m n o p q Eintrag zu Ethylendiamin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2025. (JavaScript erforderlich)
- ↑ D.H. Ripin, D.A. Evans: pKa's of Inorganic and Oxo-Acids. (PDF) Abgerufen am 15. Juli 2014 (englisch).
- ↑ a b Eintrag zu Ethylendiamin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 9. März 2019.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-232.
- ↑ Eintrag zu Ethylenediamine im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 9. März 2019. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 11. August 2018.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 107-15-3 bzw. 1,2-Diaminoethan), abgerufen am 15. September 2019.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-23.
- ↑ a b Patent WO2018224321: Verfahren zur Herstellung von Ethylenaminen. Veröffentlicht am 13. Dezember 2018, Anmelder: BASF SE, Erfinder: Regine Helga Bebensee, Thomas Heidemann, Barbara Becker, Eva Koch, Hermann Luyken, Johann-Peter Melder.
- ↑ a b Hans-Jürgen Arpe: Industrielle Organische Chemie - Bedeutende Vor- und Zwischenprodukte. 6. Auflage. WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim 2007, ISBN 978-3-527-31540-6, S. 245.
- ↑ Ethylenediamine (EDA). In: BASF Produktsuche. Abgerufen am 11. März 2022.



