| Diiodbenzole | |||||||
| Name | 1,2-Diiodbenzol | 1,3-Diiodbenzol | 1,4-Diiodbenzol | ||||
| Andere Namen | o-Diiodbenzol | m-Diiodbenzol | p-Diiodbenzol | ||||
| Strukturformel | 
|

|
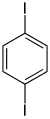
| ||||
| CAS-Nummer | 615-42-9 | 626-00-6 | 624-38-4 | ||||
| PubChem | 11994 | 12270 | 12208 | ||||
| Summenformel | C6H4I2 | ||||||
| Molare Masse | 329,91 g·mol−1 | ||||||
| Aggregatzustand | flüssig | fest | |||||
| Schmelzpunkt | 27 °C[1] | 40 °C[2] | 131–133 °C[3] | ||||
| Siedepunkt | 287 °C[1] | 285 °C[2] | 285 °C[3] | ||||
| Dichte | 2,524 g·cm−3[4] | ||||||
| GHS- Kennzeichnung |
|
|
| ||||
| H- und P-Sätze | 315‐318‐335 | 315‐319‐335 | keine H-Sätze | ||||
| keine EUH-Sätze | keine EUH-Sätze | keine EUH-Sätze | |||||
| 261‐280‐305+351+338 | 261‐305+351+338 | keine P-Sätze | |||||
Die Diiodbenzole bilden in der Chemie eine Stoffgruppe, bestehend aus einem Benzolring mit zwei Iodatomen (–I) als Substituenten. Durch deren unterschiedliche Anordnung (ortho, meta oder para) ergeben sich drei Konstitutionsisomere mit der Summenformel C6H4I2.
Eigenschaften
BearbeitenDie Siedepunkte der drei Isomere liegen relativ nah beieinander, während sich ihre Schmelzpunkte deutlicher unterscheiden. Das 1,4-Diiodbenzol, welches die höchste Symmetrie aufweist, besitzt den höchsten Schmelzpunkt.
Darstellung
BearbeitenDie Diiodbenzole können aus den entsprechenden Diaminobenzolen durch Diazotierung und anschließende Umsetzung mit Kupfer(I)-iodid erhalten werden.
Einzelnachweise
Bearbeiten- ↑ a b Morrison/Boyd: Lehrbuch der Organischen Chemie, 3. Auflage, VCH, Weinheim 1986, ISBN 3-527-26067-6, S. 1113.
- ↑ a b CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ a b c Datenblatt 1,4-Diiodbenzol bei Sigma-Aldrich, abgerufen am 7. November 2016 (PDF).
- ↑ a b Datenblatt 1,2-Diiodbenzol bei Sigma-Aldrich, abgerufen am 25. Februar 2011 (PDF).
- ↑ Datenblatt 1,3-Diiodbenzol bei Sigma-Aldrich, abgerufen am 25. Februar 2011 (PDF).
Literatur
Bearbeiten- Abil E. Aliev, Kenneth D. M. Harris, Xavier Alcobéa, Eugènia Estop: „Dynamic properties of p-diiodobenzene investigated by solid-state 2H and 13C nuclear magnetic resonance spectroscopy“, in: J. Chem. Soc., Faraday Trans., 1993, 89, S. 3797–3800; doi:10.1039/FT9938903797.
- T. V. Magdesieva, I. I. Kukhareva, G. A. Artamkina, I. P. Beletskaya, K. P. Butin: „Electrochemically induced aromatic nucleophilic substitution in p-diiodobenzene with [(η5-C5H5)Fe(CO)2]− and [(η5-C5H5)W(CO)3]−-anions“, in: Journal of Organometallic Chemistry, 1995, 487 (1–2), S. 163–166; doi:10.1016/0022-328X(94)05077-O.
- Linda C. Brazdil, Carlo J. Cutler: „Selective Production of Diiodobenzene and Iodobenzene from Benzene“, in: J. Org. Chem., 1996, 61 (26), S. 9621–9622; doi:10.1021/jo961493m.

