Pivalaldehyd
organische Verbindung, Aldehyd
(Weitergeleitet von 2,2-Dimethylpropanal)
Pivalaldehyd (auch Pivalinaldehyd) ist eine chemische Verbindung aus der Gruppe der Aldehyde. Mit seinen Isomeren Valeraldehyd (n-Pentanal), Isovaleraldehyd und 2-Methylbutyraldehyd bildet er die Stoffgruppe der Pentanale.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
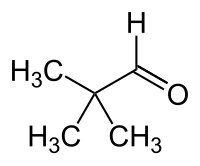
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Pivalaldehyd | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C5H10O | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 86,13 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,793 g·cm−3 (25 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
74 °C (973 hPa)[1] | ||||||||||||||||||
| Dampfdruck |
14,8 kPa (20 °C)[2] | ||||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[2] | ||||||||||||||||||
| Brechungsindex |
1,378 (20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Verwendung
BearbeitenDurch Umsetzung von Pivaldehyd mit enantiomerenreiner Milchsäure, Mandelsäure oder Prolin wird ein sterisch fixiertes Acetal erhalten, welches Anwendung in der stereoselektiven Synthese findet.[3] Die α-Hydroxycarbonsäuren (S)-Milchsäure (R = CH3) bzw. (S)-Mandelsäure (R = C6H5 = Ph) reagieren diastereoselektiv wie folgt:
Einzelnachweise
Bearbeiten- ↑ a b c d e f g Datenblatt Trimethylacetaldehyde bei Sigma-Aldrich, abgerufen am 1. Dezember 2012 (PDF).
- ↑ a b Eintrag zu Pivalaldehyd bei TCI Europe, abgerufen am 2. Dezember 2012.
- ↑ Dieter Seebach, Reto Naef: Enantioselective Generation and Diastereoselective Reactions of Chiral Enolates Derived from α-Heterosubstituted Carboxylic Acids, Helvetica Chimica Acta, 1981, 64, S. 2704–2708 (doi:10.1002/hlca.19810640829).

