| Klassifikation nach ICD-10-GM | |
|---|---|
| J09 | Grippe durch zoonotische oder pandemische nachgewiesene Influenzaviren |
| U69.21! | Influenza A/H5N1 Epidemie [Vogelgrippe] |
| ICD-10 online (GM-Version 2024) | |
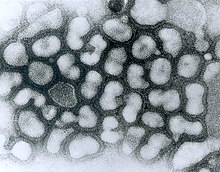

Vogelgrippe H5N1 ist eine Viruserkrankung der Vögel, hervorgerufen durch das Influenza-A-Virus H5N1. Wie alle anderen durch Influenza-Viren verursachten Geflügelkrankheiten ist auch die Vogelgrippe H5N1 bei in Gefangenschaft gehaltenen Vögeln und bei Wildvögeln in zahlreichen Ländern eine anzeigepflichtige Tierseuche, gegen die umgehend amtliche Maßnahmen zu ihrer Bekämpfung und zur Verhinderung ihrer Ausbreitung eingeleitet werden können. In Einzelfällen sind die Viren auf Säugetiere und Menschen übertragen worden, die Erkrankung ist folglich eine Zoonose. Der erste wissenschaftlich dokumentierte Ausbruch von A/H5N1 ereignete sich 1959 in Schottland.[1]
H5N1-Virus
Das Virus Influenza A/H5N1 ist ein behülltes Einzel(−)-Strang-RNA-Virus aus der Familie der Orthomyxoviridae. Der Durchmesser des Virus beträgt etwa 100 Nanometer, es besitzt etwa 14.000 Nukleotide.
Der Erhalt der Infektionsfähigkeit des Erregers ist in der Außenwelt nicht sehr hoch und kann durch die Desinfektionsmittel mit deklarierter Wirksamkeit für das Wirkungsspektrum „begrenzt viruzid“ unschädlich gemacht werden.[2] Jedoch kann das Virus – geschützt durch organisches Material wie Körpersekrete, Kot und Ähnliches – in Tierställen und insbesondere bei niedrigen Temperaturen einige Wochen überstehen. Infektiös bleiben die Viren bei 4 °C zum Beispiel ca. 30 bis 35 Tage in Kot, Geflügelfleisch oder gelagerten Eiern, bei 37 °C hingegen nur sechs Tage.[3][4] Nach bisherigen Erkenntnissen sind die Viren nicht mehr infektiös, wenn sie Temperaturen über 70 °C ausgesetzt wurden, so dass eine Übertragung über durchgegarte Eier oder andere durchgegarte Geflügel- und Fleischprodukte als ausgeschlossen gilt.
Übertragungswege von Tier zu Tier
Die Folgen der seit 1997 gehäuft auftretenden H5N1-Ausbrüche gelten laut New Scientist als die schlimmste Erkrankungswelle, die jemals unter Tieren bekannt geworden ist[5], vergleichbar allenfalls mit der Rinderpest. Grundsätzlich werden bei Zuchtgeflügel die gleichen Infektionswege wie bei anderen Influenzaviren beobachtet: Die H5N1-Viren können durch Kotpartikel verbreitet werden, die über sogenannte „Hühnerabfälle“ (Tierreste) auch in industrielles Geflügelfutter gelangen können; ferner können sie beim Schlachten über Blut sowie über Kleidung und Arbeitsgeräte verbreitet werden.
Auf einer gemeinsamen Konferenz der FAO und der Weltorganisation für Tiergesundheit (OIE) wurde Ende Mai 2006 jedoch von Forschern der Erasmus-Universität (Rotterdam) darauf hingewiesen, dass H5N1-Viren bei Wildvögeln – anders als sämtliche anderen bekannten Influenzaviren – offenbar stärker über den Atemtrakt als über den Kot ausgeschieden werden.[6] Dies erkläre möglicherweise, warum unter nahezu 100.000 Kotproben von lebenden Wildvögeln, die in den 10 Monaten vor Mai 2006 in Europa analysiert wurden, kein einziger H5N1-Fall entdeckt wurde.
Umstritten ist, welcher Anteil dem Handel mit Vögeln sowie mit Geflügelprodukten bei der Ausbreitung von A/H5N1 zukommt und welcher Anteil den Wildvögeln. Die US-amerikanische Gesundheitsbehörde CDC erläutert in diesem Zusammenhang, dass weltweit einzelne Wildvögel das Virus in sich tragen, ohne daran zu erkranken;[7] Aus Amerika wurden erstmals 2015 H5N1-Nachweise bekannt, in Australien scheint A/H5N1 bislang noch nicht angekommen zu sein.
2010 bestätigte eine Studie, dass sich mit Kleinstsendern ausgestattete Spießenten im Jahr 2008 auf ihren Flugrouten zwischen Japan und dem nordasiatischen Festland in Gewässern aufhielten, auf denen infizierte Singschwäne heimisch waren. Dies wurde als Unterstützung der Hypothese interpretiert, dass Wildvögel die Viren entlang ihrer Wanderrouten verbreiten können.[8] Auf regionaler Ebene wurde 2020 für China berechnet, dass die Verbreitung von aviären Influenzaviren auch entlang der Handelswege von Geflügel erfolgt.[9]
Das Friedrich-Loeffler-Institut veröffentlichte im Juli 2022 eine aktualisierte Risikoeinschätzung für Deutschland.[10][11] Das Risiko der Aus- und Weiterverbreitung der HPAI-H5-Viren in Wasservogelpopulationen im Zusammenhang mit der hohen Dichte in Brutkolonien oder eines zu erwartenden Wasservogelbesatzes an Mauser- und Sammelplätzen, vor allem aber an den Küstenregionen, wurde als hoch eingestuft. Das Risiko eines Eintrags in Geflügelhaltungen und Vogelbestände wurde in diesen Regionen als hoch, ansonsten als gering eingestuft.
Vögel
Die Symptome des akuten Verlaufs einer A/H5N1-Infektion sind identisch mit den Symptomen, die andere Virussubtypen der Geflügelpest hervorrufen. Besonders schwer ist der Krankheitsverlauf regelmäßig bei Hausgeflügel, insbesondere bei Hühnern und Truthühnern. Als Inkubationszeit werden von der Weltorganisation für Tiergesundheit (OIE) „maximal 21 Tage“ ausgewiesen.
Neben Zeichen allgemeiner Schwäche (Apathie, Inappetenz, stumpfes, struppiges Federkleid) treten hohes Fieber, eine erschwerte Atmung mit geöffnetem Schnabel, Ödeme (d. h. Schwellungen aufgrund Flüssigkeitsaufstauung) an Kopf, Hals, Kamm, Kehllappen, Beinen und Füßen, Blauverfärbung von Haut und Schleimhäuten, wässerig-schleimiger und grünlicher Durchfall, neurologische Störungen (sonderbare Haltung des Kopfes, Störungen der Motorik) auf. Die Legeleistung sinkt, die Eier sind dünnwandig oder schalenlos. Die Mortalität in infizierten Hausgeflügelbeständen ist sehr hoch: Der Tod tritt bei nahezu allen Tieren ein.
Wildlebende Wasservögel
A/H5N1 fiel in Asien zunächst dadurch auf, dass durch dieses Virus auch viele von anderen Influenza A-Viren weniger stark gefährdete Zugvögel getötet wurden. Influenza A-Viren sind unter wildlebenden Enten und anderen Wasservögeln weit verbreitet; diese Tiere werden daher als „natürliches Reservoir für das Virus“ bezeichnet. Charakteristisch für solche Reservoirwirte ist häufig, dass sie selbst gar nicht oder zumindest nicht schwer erkranken. Evolutionsbiologen deuten derartige Formen einer Koexistenz dahingehend, dass sich auf längere Sicht vor allem jene Virus-Varianten in der Population ihrer Reservoirwirte verbreiten, die ihre Wirte nicht töten. Wird nämlich der Wirt – zumal sehr rasch – getötet, stirbt mit ihm auch die im Wirt ansässige Viren-Population ab; größere Vermehrungschancen haben daher jene Varianten eines Virustyps, die ihn langfristig zur Vermehrung und Verbreitung nutzen (attenuierte Viren).
Wanderwasservögel, See- und Küstenvögel gelten als weniger anfällig für die Erkrankung. Aber auch sie können Vektoren sein, und ihr Wanderverhalten (Vogelzug) kann zur Verbreitung beitragen.
In Südchina und Hongkong wurden seit Anfang 2003 mehr als 13.000 Kot- und andere Proben von Wildvögeln auf A/H5N1 untersucht, ohne dass zunächst Viren gefunden wurden. Erst Anfang 2005 wurden H5N1-Viren bei sechs offensichtlich gesunden Wildenten am Poyang-See in der chinesischen Provinz Jiangxi nachgewiesen. Die chinesischen Forscher hatten ferner mehr als tausend serologische Proben von Wildenten untersucht und bei drei Prozent davon Antikörper gegen A/H5N1 entdeckt, was als Anzeichen einer früheren Infektion bewertet wurde. Die Forscher vermuteten, dass einzelne Zugvögel die Viren über große Strecken verbreiten können, dass gehäufte lokale Ausbrüche hingegen auf infiziertes Nutzgeflügel zurückzuführen seien.[12]
Vergleichbare Ergebnisse wurden 2007 aus Europa bekannt: Forscher aus Schweden und den Niederlanden hatten in Nordeuropa über acht Jahre hinweg 37.000 frei lebende Wasservögel untersucht und bei sechs Prozent der Tiere Influenza-Viren nachweisen können, jedoch keine einzige H5N1-Infektion.[13]
Das erste große Massensterben unter Wildvögeln war ein H5N1-Ausbruch am nordchinesischen Qinghai-See (einem Rastplatz für Zugvögel), wo 2005 zahlreiche Streifengänse verendeten.
Hausgeflügel
Eine Infektion mit A/H5N1 oder mit anderen Influenza-A-Viren kann besonders bei Hühnern und Puten, aber auch bei Fasanen, Wachteln und Perlhühnern zu schwerwiegenden Krankheitszuständen bis hin zum raschen Tod führen. Tauben sollen zwar selbst nicht sehr empfänglich für A/H5N1 sein, es wird aber befürchtet, dass sie die Erreger als mechanische Vektoren im Gefieder verbreiten. Wegen des möglichen, erheblichen wirtschaftlichen Schadens wurden auf der Grundlage nationaler Tierseuchengesetze durch diverse Verordnungen – in Deutschland zum Beispiel durch die Geflügelpest-Verordnung – Vorkehrungen für Schutzmaßnahmen nach dem Auftreten von Influenza-Infektionen getroffen.
Von welchen Wirtstieren A/H5N1 erstmals auf Zuchtgeflügel überging, ist bisher nicht bekannt. Es wird jedoch vermutet, dass die Viren bereits vor ihrem ersten Hervortreten unter Hühnervögeln (im Jahr 1997 in Hongkong) unter südchinesischen Enten und Gänsen verbreitet waren. Aufgrund der raschen Reaktion der Behörden von Hongkong, die 1997 den gesamten Zuchtgeflügelbestand töten ließen, habe man damals offenbar alle für Hühnervögel gefährlichen Virusvarianten ausrotten können.
Bei den erneuten Ausbrüchen des Erregers Ende 2003/Anfang 2004 in anderen Regionen Südostasiens wurde nicht mit ähnlich drakonischen Maßnahmen reagiert, so dass sich A/H5N1 von Jahr zu Jahr weiter ausbreiten konnte. Ein Vorgehen wie in Hongkong wäre angesichts der wirtschaftlichen Bedeutung, die der Geflügelzucht in anderen Regionen Südostasiens heute zukommt, kaum durchsetzbar gewesen. Thailand, Indonesien und Vietnam haben ihre Geflügelproduktion etwa von 1975 bis 2005 verachtfacht, die chinesische Produktion hat sich in den 1990er-Jahren verdreifacht. Das Hühnerfleisch stammt heute weit überwiegend aus Mastfabriken, die in der Nähe großer Städte liegen und Großunternehmen gehören; für Viren kann die Massentierhaltung gute Vermehrungsbedingungen bewirken. Auch rund um den Qinghai-See, wo 2005 erstmals ein Massensterben von Wildvögeln durch A/H5N1 nachgewiesen wurde, gibt es nach Angaben der Vogelschutzorganisation BirdLife zahlreiche Geflügelfarmen. Mit Unterstützung der FAO sei dort zudem eine Fischfarm errichtet worden, wobei der Hühnerkot aus den Geflügelfarmen als Fischfutter genutzt worden sei.
Im Sommer 2005 haben Robert G. Webster vom St. Jude Children’s Research Hospital in Memphis (USA) und seine Forscherkollegen aus Asien festgestellt, dass der Subtyp A/H5N1 die Hausenten in Asien inzwischen weniger stark erkranken lässt als noch vor Jahren. Damit bestehe die Gefahr, dass diese Hausenten als neue Reservoirwirte zu einem Sammelbecken für A/H5N1-Varianten werden und sie somit auch die Erreger auf andere Tierarten und den Menschen zunehmend übertragen können, denn sie scheiden die Viren ungewöhnlich lange über Kot und Atemwege aus. Tatsächlich wurden aus China ab 2006 einzelne H5N1-Infektionsfälle beim Menschen an die Weltgesundheitsorganisation (WHO) gemeldet, bei denen die Infektion offenbar durch Geflügel verursacht worden war, das dem äußeren Anschein nach „gesund“ war und das aus einem Gebiet stammte, in dem keine Wild- oder Zuchttiere an A/H5N1 verstorben waren.
Säugetiere
Säugetiere sind weniger empfänglich für das Virus, wurden aber in der vergangenen Jahren ebenfalls gelegentlich infiziert. Bereits im Mai 2005 hatte beispielsweise die Fachzeitschrift Nature berichtet, dass offizielle Stellen in Indonesien A/H5N1 in Schweinen nachgewiesen hatten. Abstriche aus der Nase von 702 gesundheitlich nicht auffälligen indonesischen Schweinen, die zwischen 2005 und 2007 analysiert worden waren, erbrachten den Nachweis, dass 52 Tiere (7,4 %) mit H5N1-Viren infiziert waren.[14] Zuvor hatte es bereits aus China Berichte über H5N1-Funde in Schweinen gegeben.[15]
Der niederländische Forscher Albert Osterhaus wurde in der Zeit vom 19. Januar 2006 zitiert, dass A/H5N1 Hunde, Pferde, Pumas, Tiger und Leoparden infiziert habe, im Tierversuch auch Mäuse, Frettchen, Affen und Hauskatzen. Im März 2006 wurde zudem auf der Insel Rügen ein infizierter Steinmarder entdeckt.
Erstmals 2022 wurde auch bei einem Schweinswal A/H5N1 nachgewiesen, der am 28. Juni 2022 in Schweden (Kämpersvik, Gemeinde Tanum, Västra Götalands län) lebend gestrandet, jedoch bald verendet war.[16]
Im März 2024 berichteten US-amerikanische Gesundheitsbehörden, dass in Texas und Kansas weltweit erstmals A/H5N1 bei Milchkühen nachgewiesen wurde und dass es einen Übergang des Virus auf einen Menschen gab.[17] Die Kühe waren auffällig geworden durch Appetitlosigkeit und verminderte Milchbildung, H5N1-Viren wurden aus unpasteurisierter Milch und aus Abstrichen aus dem Mund-Rachen-Raum der Tiere isoliert. Der Patient litt an einer Bindehautentzündung und zeigte keine weiteren Symptome. Da auf dem Gelände der Milchkuh-Halter verendete Wildvögel gefunden wurden, ist nicht auszuschließen, dass A/H5N1 auf diesem Wege in die Tierhaltung eindrang. Nachfolgende Untersuchungen ergaben, dass auch in mehreren anderen US-Bundesstaaten H5N1-infizierte Milchkühe und auf dem Gelände von Milchkuh-Haltern infizierte Katzen nachgewiesen wurden.[18] Ein zweiter Übergang von Kühen auf den Menschen wurde Ende Mai 2024 bekannt.[19] Die Hausrinder überstehen die Infektion in der Regel, viele ohne sichtbare Zeichen einer Infektion.[20] Katzen, die von der Rohmilch infizierter Kühe getrunken hatten, starben dagegen häufig.[21]
Fische
Laut FLI besteht nach heutigem Stand der Wissenschaft kein Grund zur Besorgnis, dass Fische sich mit A/H5N1-Viren infizieren und dieses auf den Menschen übertragen können. Es sind bis heute keine Viren bei Vögeln und Säugern bekannt, die für Fische infektiös wären. Umgekehrt ist bisher auch keine Viruserkrankung bei Fischen nachgewiesen worden, die auf den Menschen oder auf Vögel übertragbar ist.
Weltweite Ausbreitung ab 2004
Bereits 1959 und 1991 war es in Großbritannien zu zwei lokal begrenzten Ausbrüchen einer schon zuvor bekannten, minder virulenten Form von A/H5N1 in Geflügelhaltungen gekommen. Zunächst 1997 und danach zwischen Dezember 2003 und Sommer 2004 gab es, von der Region um Hongkong ausgehend, in mehreren Staaten in Südost- und Ostasien wiederholt größere Ausbrüche einer vermutlich erst 1996 neu entstandenen, hoch virulenten Variante von A/H5N1 unter Zuchtgeflügel. Betroffen waren anfangs die Volksrepublik China, Südkorea, Thailand, Vietnam, Indonesien, Kambodscha, Malaysia und Japan. Im Jahr 2005 wurden zudem mehrere größere Ausbrüche unter frei lebenden Vögeln beobachtet.[22]
Vor allem Transporte zwischen Geflügelfarmen, aber auch Vogelzüge werden dafür verantwortlich gemacht, dass sich die Seuche ab 2005 immer weiträumiger ausbreiten konnte.[23][24][25]
Im Sommer 2005 wurde A/H5N1 außerhalb Südostasiens zunächst in Geflügelbeständen in Sibirien (Region Nowosibirsk) und in Kasachstan nachgewiesen, ferner in der Mongolei und später im Ural. Ab Oktober 2005 gab es bestätigte H5N1-Infektionen unter Geflügel in Rumänien, in Kroatien und in der Türkei. Im November 2005 wurde A/H5N1 auch (bei einem einzelnen Tier) in Kuwait nachgewiesen, ferner gab es seitdem wiederholt Ausbrüche in der Ukraine.
Bereits Anfang 2006 war die Ausbreitung des Erregers A/H5N1 nach Ansicht des Vorsitzenden des Influenza-Programms der Weltgesundheitsorganisation, Klaus Stöhr, nicht mehr zu stoppen. „Das haben wir zwar geglaubt, als das Virus bei den Wildvögeln noch nicht verbreitet war“, sagte Stöhr am 14. Februar 2006 im hr. Wegen der Übertragung durch Wildvögel seien dann aber viele Maßnahmen zur Eindämmung der Ausbreitung des Erregers – wie Gepäckkontrollen und das Verbot von Tiertransporten – ineffektiv geworden.
Die Fachzeitschrift New Scientist wies in ihrer Ausgabe vom 18. Februar 2006 darauf hin, dass alle Ausbrüche in Europa und Afrika „bisher in der Nähe der Überwinterungsplätze von Enten, die den Sommer in Sibirien verbringen“, gelegen hätten. Am 13. Mai 2006 wurde in New Scientist am Beispiel der Spießenten[26] aufgezeigt, dass aufgrund überlappender Siedlungsgebiete von Teilpopulationen die Ost-West-Ausbreitung von A/H5N1 und aufgrund von Nord-Süd-Wanderungen die Ausbreitung von Sibirien in den Nahen Osten und nach Afrika erklärt werden könne.
Die Ernährungs- und Landwirtschaftsorganisation der UNO (FAO) teilte andererseits bereits im November 2005 mit, dass auch nach umfangreichen Tests in den betroffenen Ländern unter den klinisch unauffälligen Zugvögeln keine A/H5N1-Viren nachweisbar gewesen seien. Alle weltweit positiv getesteten Wildvögel seien tot und überwiegend in der Nähe von Geflügelfarmen gefunden worden. Auch unter 11.000 in den Jahren 2006 und 2007 in 19 Ländern Osteuropas, des Nahen Osten und Afrikas überprüften Wildvögeln war kein einziges H5N1-infiziertes Individuum.[27]
Eine Gruppe von US-Ornithologen hatte im Fachblatt Science bereits 2006[28] mitgeteilt, dass Japan seit 2004 frei von A/H5N1 geblieben sei, nachdem das Land strenge Kontrollen bei Geflügelimporten eingeführt habe. Japan liege aber im Gebiet von Vogelzügen aus Südchina und anderen Gebieten mit wiederholten H5N1-Ausbrüchen. Auch diese Ornithologen schlossen daraus, dass als Ursache für die H5N1-Ausbreitung sehr wohl auch Geflügeltransporte, kontaminierte Transportbehältnisse und infektiöser Abfall infrage kommen könnten. Erst 2007 kam es in Japan erneut zu einem kurzzeitigen H5N1-Ausbruch.
Wissenschaftler gehen davon aus, dass H5N1 im Jahr 2020 in Asien eine neue Form (mit der wissenschaftlichen Bezeichnung „Klade 2.3.4.4b“) angenommen haben muss und seitdem noch aggressiver wirkt. Unter den Wildvögeln der Welt hat diese Variante ab 2020 zu einer beispiellosen Seuche geführt: Millionen Tiere auf allen Kontinenten außer Australien sind verendet.[21] Beispielsweise wurden bei weltweit rund 3000 Ausbrüchen zwischen November 2021 und Mai 2022 mehr als 77 Millionen Zuchtvögel getötet, zudem wurden 400.000 verendete Wildvögel registriert.[29] Im Herbst 2022 wurden zudem in Spanien mehr als 50.000 infizierte Nerze getötet.[30] Im Jahr 2023 verursachte es in Südamerika ein Massensterben unter Seelöwen und See-Elefanten. Im selben Jahr war es in den USA auf Hausrinder übergesprungen, wobei Rinder die Infektion in der Regel überstanden. Im Folgejahr wurden in den USA Erkrankungsfälle bei Menschen beobachtet.[21]
Südostasien
Seit 2006 wurden aus zahlreichen Staaten Südostasien wiederholt H5N1-Infektionen an die Weltorganisation für Tiergesundheit (OIE) gemeldet. Besonders verbreitet war das Virus demnach anfangs in China und Hongkong, danach in Thailand, Vietnam, Malaysia und Kambodscha; später griff es auf Südkorea, Indien, Pakistan, Bangladesch, Myanmar (Birma), Afghanistan und Laos über. In Japan kam es Anfang 2004, im Januar 2007 sowie im April 2008 zu kleineren Ausbrüchen von A/H5N1. Im Januar 2009 wurde das Virus erstmals auch in Nepal nachgewiesen,[31] im April 2013 wurden in Nordkorea 164.000 Enten nach H5N1-Infektionen getötet.[32] Eine ähnlich große Zahl an verstorbenem und vorbeugend getötetem Geflügel wurde im Jahr 2013 auch aus Nepal gemeldet.[33]
Sibirien, Europa, Naher Osten
Nach den großen H5N1-Ausbrüchen im Jahr 2005 wurden aus Sibirien und aus den Nachfolgestaaten der Sowjetunion seit 2006 nur wenige H5N1-Infektionen bekannt. Zu einer größeren Infektionskette kam es jedoch im Februar 2007, für die sich der „Sadovod-Markt“ in Moskau als Ausgangspunkt erwies.[34]
Allerdings kam es ab Jahresbeginn 2006 erstmals zu H5N1-Ausbrüchen in der Türkei und in Nordzypern, im Irak, in Iran, in Israel, Jordanien und den Palästinensischen Autonomiegebieten. In Osteuropa wurden aus Rumänien besonders viele Ausbrüche gemeldet, was – auch im Land selbst – auf ein mangelhaftes Krisenmanagement zurückgeführt wurde. Betroffen von H5N1-Infektionen waren ab 2006 ferner Polen, Ungarn, die Slowakei, Slowenien, Bulgarien, Albanien, und Serbien.
Vermutlich von Osteuropa und der Westtürkei ausgehend, verbreitete sich die H5N1-Infektion Anfang 2006 dann einerseits Richtung Südeuropa nach Griechenland und bis nach Sizilien, andererseits entlang der Ostsee bis nach Norddeutschland und Dänemark. Österreich, Süddeutschland und die Schweiz lagen im Bereich einer dritten Ausbreitungswelle. Auch in den folgenden Jahren wurde in Europa vereinzelter H5N1-Befall registriert, so u. a. im Januar 2007 in ungarischen und südostenglischen Geflügelbeständen, im Sommer 2007 in Lothringen sowie in mehreren deutschen Bundesländern bei tot aufgefundenen Wildvögeln und im November 2007 erneut in England an der Grenze zwischen Norfolk und Suffolk. Im Frühjahr 2008 wurden beispielsweise bei Luzern infizierte Wildvögel entdeckt, im Oktober 2008 der Befall eines Geflügelbestands in Sachsen und Anfang März 2009 39 infizierte Wildenten am Starnberger See.
Deutschland und Europa erlebten 2020/21 laut Friedrich-Loeffler-Institut die bis dahin schwersten Geflügelpest-Ausbrüche, überwiegend verursacht durch A/H5N1, jedoch auch durch A/H5N8, und zwar sowohl unter Wildvögeln als auch unter Zuchtgeflügel.[35] Übertroffen wurde dieses Ausbruchsgeschehen bereits 2021/22: Infolge von fast 2500 Ausbrüchen bei Geflügel wurden 47,7 Millionen Vögel in betroffenen Betrieben gekeult.[36] Der Berliner Zoo schloss am 18. November 2022 auf unbestimmte Zeit seine Tore für die Besucher, da ein am 13. November verstorbener Vogel positiv auf das H5N1-Virus getestet wurde.[37] Seither wurde das Virus auch in der Schweiz vereinzelt nachgewiesen. Dort wurden per 28. November 2022 landesweite Maßnahmen (u. a. eine weitgehende Stallpflicht für sämtliches Geflügel) zur Vorbeugung erlassen,[38] welche dann in mehreren Schritten[39][40] bis und mit dem 30. April 2023 verlängert wurden.[41] Bereits am 25. Mai 2023 wurden per 27. Mai lokale Maßnahmen in Kraft gesetzt, welche voraussichtlich bis am 31. Juli 2023 gelten.[42] Am 26. Juli wurden diese bis 15. Oktober 2023 verlängert.[43]
Afrika, Arabische Halbinsel
Anfang Januar 2006 kam es erstmals in Afrika, in der nigerianischen Stadt Jaji im Bundesstaat Kaduna, in einer großen Legehennen-Batterie zu einem Ausbruch von A/H5N1. Bis Ende Juni 2006 wurden aus 14 der 31 Bundesstaaten Nigerias H5N1-Infektionen gemeldet.[44] Weitere Ausbrüche wurden danach aus Niger, Ägypten, Kamerun, Sudan, Burkina Faso, Dschibuti, Elfenbeinküste, Ghana und Togo bekannt.
Am 13. Februar 2007 wurden im Zoo von Kuwait mehrere erkrankte Falken entdeckt, bei denen später eine H5N1-Infektion nachgewiesen wurde. Zugleich wurden andernorts in Kuwait mehrere Dutzend an A/H5N1 erkrankte Hühner festgestellt, die auf lokalen Märkten verkauft worden waren. Am 12. März 2007 wurde in Saudi-Arabien (Provinz asch-Scharqiyya) laut Meldung des Agrarministeriums an die OIE ein örtlich begrenzter Ausbruch unter Geflügel festgestellt, der auf „Kontakt mit Wildvögeln“ zurückgeführt wurde. Ende 2007 wurde der erste H5N1-Nachweis aus Benin bekannt. Im Oktober 2009 stürzten neun Geierraben auf einen Schulhof in Cocody (Elfenbeinküste) und verendeten dort an den Folgen der H5N1-Infektion.
Nordamerika
Erstmals im Januar 2015 wurde eine hochpathogene Variante von A/H5N1 in Nordamerika nachgewiesen, in Whatcom County, Washington, und zwar in einem abgeschossenen Wildvogel, einer Nordamerikanischen Krickente (Anas carolinensis); den Analysen zufolge handelt es sich bei dieser Variante um eine bis dahin unbekannte Reassortierung.[45] Einige Gene dieser H5N1-Variante sind weitgehend identisch mit einem Virusfund im Dezember 2014 im gleichen Washingtoner County. Dort hatte man in einem privat gehaltenen Gerfalken den Subtyp A/H5N8 entdeckt;[46] andere Gene sind den Analysen zufolge vom Subtyp A/H5N2 im Wege der Reassortierung auf A/H5N1 übergegangen. Bestätigt wurde diese Interpretation anhand von Virusnachweisen aus einer Kanadapfeifente.[47] Kurz darauf, Anfang Februar 2015, wurde A/H5N1 auch in Kanada nachgewiesen, in einem privaten Hühnerbestand in British Columbia.[48]
Ab November 2021 wurde zunächst im Osten Kanadas, ab Anfang Februar 2022 im US-Bundesstaat Indiana und danach in mehr als 20 anderen US-Bundesstaaten bei Wildvögeln und in Tierhaltungen A/H5N1 nachgewiesen. Bis Anfang April 2022 wurden mehr als 23 Millionen Hühner und Puten getötet[49] und im April 2022 weitere 10 Millionen. Dieser Vogelgrippe-Ausbruch gilt als der bis dato größte in Nordamerika.[50]
Im Jahr 2023 gelang es der H5N1-Variante mit der wissenschaftlichen Bezeichnung Klade 2.3.4.4b erneut eine Artengrenze zu überspringen, obwohl der Übersprung auf Kühe zuvor kaum für möglich gehalten wurde[21], weil Rinder kein bekannter Wirt für diese Art von Grippeviren waren.[51] Bis Mitte 2024 waren Rinderherden in 12 Bundesstaaten betroffen.[21]
Antarktis
Im Februar 2024 wurde das H5N1-Virus in einen Monat zuvor tot aufgefundenen Raubmöwen in der Nähe der argentinischen Basis Primavera (bei Cierva Cove) nachgewiesen.[52]
Bekämpfung
Die UN-Organisation für Landwirtschaft und Ernährung (FAO) hat Ende Mai 2006 Richtlinien herausgegeben, die zur Reduzierung der Ansteckungsgefahr mit A/H5N1 beitragen sollen. Die Empfehlungen befassen sich sowohl mit dem Ansteckungsrisiko von Tier zu Tier als auch von Tier zu Mensch, ferner werden Ratschläge zur Haltung von Geflügel sowie Tipps zur Verbesserung der Hygiene beim Umgang mit verendeten Tieren gegeben: Diese Tiere müssten verbrannt oder tief vergraben werden (s. auch Weblinks, FAO-Richtlinie). In den einzelnen betroffenen Ländern wurden häufig ähnliche, zum Teil aber auch sehr unterschiedliche Maßnahmen verordnet.
In der EU erfolgt die Bekämpfung von A/H5N1 aufgrund von EU-Recht sowie zusätzlich in allen europäischen Staaten auf der Grundlage nationaler Gesetze. In Deutschland ist dies vor allem das Tierseuchengesetz und die aus ihm abgeleitete Geflügelpest-Verordnung.
Vorbeugende Tötungen und Handelsbeschränkungen
Diese Regelungen schreiben derzeit vor, dass bei Ausbrüchen von Influenza-Erkrankungen in der Tierhaltung der gesamte Tierbestand der betroffenen Halter zu töten ist. Die Kadaver werden verbrannt oder auf andere Weise unschädlich gemacht, um eine Übertragung auf andere Tierbestände zu verhindern. Daher ist die Anzahl der getöteten Tiere regelmäßig sehr viel größer als die Zahl der nachweislich infizierten Tiere. Dies wiederum hat zur Folge, dass keine verlässlichen Daten über die Anzahl erkrankter Tiere und auch nur grobe Schätzungen zur Zahl der vorbeugend getöteten Tiere existieren. Ferner werden Schutzzonen um den Fundort infizierter Tiere eingerichtet, in denen der Transport von Vögeln und Geflügelprodukten teils untersagt, teils genehmigungspflichtig ist. Diese ursprünglich für Influenza-Erkrankungen in der Tierhaltung gedachten Schutzmaßnahmen werden nunmehr auch auf Einzelfunde infizierter Wildvögel angewandt.
Auf Basis dieser Rechtslage sind in Deutschland u. a. seit 30. Oktober 2005 Geflügelmärkte und Vogelbörsen nur noch in Ausnahmefällen erlaubt; in einzelnen deutschen Bundesländern und in Österreich sind sie sogar ganz verboten. Bei einer Jagd dürfen keine Lockvögel mehr eingesetzt und Geflügelbestände dürfen nur noch mit Leitungswasser getränkt werden. Eine Entnahme von Trinkwasser aus freier Natur (Flüsse, Bäche, Seen, Tümpel usw.) ist zurzeit untersagt.
Ferner gilt seit Mitte Februar 2006 in Deutschland und Österreich sowie in zahlreichen anderen Ländern ein Verbot der Freilandhaltung von Geflügel („Stallpflicht“), für das in Deutschland seit Mitte Mai 2006 allerdings diverse Ausnahmeregelungen gelten. Zahlreiche Entwicklungs- und Schwellenländer haben die so genannte Hinterhofhaltung verboten oder beschränkt, was von den Betroffenen und von Gegnern der Geflügelkonzerne scharf kritisiert, von der Agrarindustrie aber begrüßt wird.
Die Europäische Union und die Schweiz haben außerdem einen Importstopp für alles Geflügel sowie für Wildvögel, Geflügelfleisch, Eier und unbehandelte Federn aus den von H5N1-Ausbrüchen betroffenen Ländern verhängt. In den meisten Ländern werden die Importe und der Binnenhandel mit Bruteiern und Hühnern allerdings nicht oder nicht wirksam kontrolliert. Ein Beispiel ist die Türkei, wo A/H5N1 laut FAO verbreitet wurde, indem Fabrikfarmen minderwertiges Geflügel in großen Mengen an mittellose Kleinbauern abgaben.
Noch in den Anfängen steht die Überwachung des internationalen Handels mit industriellem Geflügelfutter, das auch Hühnerfleisch und Hühnerabfall und damit Reste von Kot, Federn oder Einstreu enthält.
Wildvogel-Monitoring
Um einheimisches Geflügel vor einer möglichen Übertragung von Influenzaviren durch Wildvögel zu schützen, wird seit 2005 in Europa auch ein erweitertes Überwachungsprogramm (Wildvogelmonitoring) durchgeführt, vorrangig bei wild lebenden Enten und Gänsen. Das Beprobungsprogramm stützt sich u. a. auf Sentinel-Anlagen („Wächtertieranlagen“), in denen flugunfähige Stockenten gehalten und frei lebende Wildvögel durch regelmäßige Futtergaben angelockt werden,[53] auf Beringungsstationen, Naturschutzbehörden und Jäger. Proben wie Rachen- und Kloakentupfer, Blut oder Kot werden an die zuständige Untersuchungseinrichtung geschickt und dort auf Influenzaviren getestet.
Nachdem sie über acht Jahre hinweg in Schweden und den Niederlanden knapp 37.000 frei lebende Enten, Gänse und andere Wasservögel auf Influenzaviren untersucht hatten, berichtete eine Expertengruppe im Frühjahr 2007, dass im Mittel bei sechs Prozent der Tiere Influenzaviren nachweisbar waren, jedoch keine A/H5N1-Viren. Die Infektionsraten unterlagen erheblichen jahreszeitlichen Schwankungen: Während im Frühjahr nur selten Influenzaviren gefunden wurden, erwiesen sich im Herbst über 20 Prozent der Enten als influenzainfiziert.[54]
Impfungen
Für Tiere gibt es seit langem eine Reihe wirksamer Totimpfstoffe gegen Influenzaviren, ferner wurden – u. a. in China – seit 2005 mehrere Lebendimpfstoffe zur Marktreife entwickelt.[55] In Deutschland ist die Impfung gegen die Geflügelpest allerdings nur in Ausnahmefällen erlaubt. Für Hühner gibt es auch einen zugelassenen DNA-Impfstoff.[56]
Auch die Weltgesundheitsorganisation warnte wiederholt nachdrücklich vor Impfungen, da geimpfte Tiere nicht mehr von virentragenden Tieren unterschieden werden könnten. Überdies könnten geimpfte, infizierte Vögel zu Überträgern der Viren werden, ohne selbst Symptome zu zeigen. Auch bestehe die Gefahr, dass die Viren in unerkannt infizierten Tieren mutieren und dass diese Erbgutveränderungen sich leichter ausbreiten könnten als in nicht-geimpften Beständen, da diese ja nach jedem Ausbruch getötet würden; eine derartige Entwicklung wurde nach einem H5N2-Ausbruch in Mexiko beobachtet. Dennoch gab es am 20. Oktober 2005 seitens der EU die Forderung an die Mitgliedsländer, Impfprogramme für Zootiere vorzubereiten. Besonders bei seltenen Arten dürfen die einzelnen deutschen Bundesländer seitdem das Impfen von Zootieren zulassen.
Am 15. November 2005 wurde der Generaldirektor der Weltorganisation für Tiergesundheit (Weltorganisation für Tiergesundheit, OIE) in Pressemeldungen zitiert, dass A/H5N1 in Vietnam und Indonesien nicht mehr eingedämmt werden könne, indem man dort nur Tiere schlachte. Er sprach sich daher für eine flächendeckende Impfung der Tiere aus. Am gleichen Tag kündigte die Volksrepublik China eine Impfung ihres gesamten Geflügelbestandes an, der nach offiziellen Schätzungen 15 Milliarden Tiere umfassen soll. Seit den H5N1-Ausbrüchen in Nigeria werden auch in dieser Region in großem Umfang Impfungen durch UN-Organisationen vorgenommen, da die Seuche durch andere Maßnahmen nicht mehr einzudämmen sei.
Ende Oktober 2006 wurde bekannt, dass sich bereits seit Herbst 2005 ein neuer Subtyp des Fujian-Stammes in Südostasien ausgebreitet hat, der die seit 2003 bekannten Virus-Varianten verdrängt hat. Bis August 2006 wurde er in 12 chinesischen Provinzen nachgewiesen, zu diesem Zeitpunkt hatte er bereits mindestens 22 Personen infiziert. Eine Besonderheit dieser Erkrankungen war, dass weder vorher noch nachher in der Nähe dieser Personen – zumeist Stadtbewohner – Infektionsherde unter Geflügel festgestellt werden konnten, so dass unklar ist, wie sich die Personen angesteckt haben. Die untersuchenden Forscher äußerten die Befürchtung, dass die in China üblichen Impfungen von Geflügel gegen A/H5N1 die Ausbreitung des neuen Subtyps begünstigt haben, da bekannt sei, dass nicht alle Tiere eine vollständige Immunität erlangten. So könnten sich Viren in geimpften Tieren vermehrt und durch Mutationen an deren veränderte Immunabwehr angepasst haben.[57]
Forscher der University of Hongkong um Yi Guan hatten zudem in Südchina wiederholt Proben von Geflügel genommen, das auf lokalen Märkten verkauft wurde. 2004 wurden 0,9 Prozent allen Geflügels positiv auf H5N1 getestet (aber zwei von 100 Enten), im Juni 2006 jedoch bereits 2,4 Prozent allen Geflügels und 3,3 Prozent der Enten.[58] Der neue Subtyp des Fujian-Stammes war im September 2005 für drei Prozent aller H5N1-Infektionen bei Geflügel verantwortlich, im Juni 2006 jedoch für 95 Prozent. Die Hongkonger Forscher befürchten, dass die steigende Verbreitung von H5N1-Viren durch scheinbar gesundes Geflügel das Risiko eines Übergangs vom Geflügel auf den Menschen deutlich erhöht hat.[59]
Die Befürworter von Impfungen verweisen darauf, dass es mit Hilfe eines Antikörpertests routinemäßig möglich sei, Influenza-Infektionen auch bei geimpften Tieren nachzuweisen. Der Impfstoff rege die Tiere zur Herstellung von Antikörpern an, die sich geringfügig – aber nachweisbar – von jenen Antikörpern unterscheiden, die der so genannte Wildtyp hervorruft. Ein solcher Impfstoff sei in Norditalien bei Verona bereits mehr als ein Jahr lang erfolgreich im Kampf gegen H5- und H7-Ausbrüche eingesetzt worden. Geimpfte Truthühner, so die Erfahrungen in Italien, seien zudem wesentlich schwieriger mit Influenzaviren zu infizieren und schieden im Falle einer Infektion wesentlich weniger Viren aus.
Anzeigepflichtige Tierseuche
Wie alle anderen durch Influenzaviren verursachten Geflügelkrankheiten („Geflügelpest“) ist in Deutschland die Erkrankung eine anzeigepflichtige Tierseuche (§ 1 Nr. 11 der Verordnung über anzeigepflichtige Tierseuchen).
Übergänge von A/H5N1 auf Menschen
Das Robert Koch-Institut schreibt unter der Überschrift „RKI zu humanen Erkrankungen mit aviärer Influenza (Vogelgrippe)“ unter anderem:
- „Unter ‚Vogelgrippe‘ (aviäre Influenza) versteht man in erster Linie eine Erkrankung durch Influenza A-Viren bei Vögeln. Diese Viren können unter Umständen auch Erkrankungen bei Menschen hervorrufen, was ebenfalls als Vogelgrippe bezeichnet wird. Aviäre Influenzaviren können nicht so leicht von Tieren auf den Menschen übertragen werden. Wenn eine solche Infektion jedoch stattfindet, kann die Krankheit bisweilen sehr schwer verlaufen. Es gibt derzeit weltweit keine Hinweise für eine fortgesetzte Mensch-zu-Mensch-Übertragung mit aviären Influenzaviren“[60]
Übergänge von A/H5N1 von Geflügel auf den Menschen waren bislang sehr selten, führten aber bei den Infizierten häufig zu einem tödlich endenden Verlauf.[61] Vor allem Menschen mit intensivem Kontakt zu infizierten Tieren, zum Beispiel beim Schlachten (Umgang mit Blut und Kot sowie beim Rupfen von Federn) laufen Gefahr, eine A/H5N1-Infektion zu erleiden. So hatten alle Anfang 2006 in der Türkei an den Folgen einer H5N1-Infektion gestorbenen Kinder nach Angaben der WHO zuvor unmittelbaren Kontakt zu erkranktem Geflügel.
Mehrere Übergänge von Mensch zu Mensch sind möglicherweise vorgekommen, konnten aber nicht mit letzter Sicherheit nachgewiesen werden (einige Beispiele siehe im Artikel Verbreitung von H5N1).
Laut Friedrich-Loeffler-Institut besteht bei Brauchwasser aus Regenwasser-Nutzungsanlagen und in Badeseen generell ein allenfalls geringes Risiko der Übertragung von Viren. Dies wird u. a. damit begründet, dass beides auch bei der Verbreitung von bakteriell verursachten Magen-Darm-Erkrankungen keine epidemiologisch relevante Rolle spielt, obwohl im Vogelkot ständig solche potentiell pathogenen Bakterien vorhanden sind.
Gesicherte Erkrankungs- und Todesfälle
Die einzig zuverlässige Statistik über H5N1-Erkrankungen bei Menschen ist die offizielle Statistik der Weltgesundheitsorganisation. Jedoch sollte insbesondere die aus der WHO-Statistik hervorgehende, extrem hohe Todesrate sehr zurückhaltend interpretiert werden, „da eine unbekannte Anzahl milder Krankheitsverläufe nicht diagnostiziert und gemeldet wird“.[62] Die Fachzeitschrift Science wies beispielsweise 2006 darauf hin,[63] dass damals weder Kambodscha noch Laos über ein Labor zur Untersuchung von H5N1-Verdachtsfällen beim Menschen verfügten; bezeichnenderweise wurde die H5N1-Infektion des ersten aus Laos stammenden Todesopfers (eine am 7. März 2007 verstorbene Fünfzehnjährige aus Vientiane) erst diagnostiziert, nachdem sie in ein thailändisches Krankenhaus gebracht worden war. Auch in den ländlichen Regionen Indonesiens sterben laut Nature täglich tausende Menschen an Infektionskrankheiten, ohne dass eine genaue Analyse der Erreger vorgenommen wird.[64]
Ebenfalls angezweifelt wird von Experten die Verlässlichkeit der aus China gemeldeten Fallzahlen. Das Land hatte erst seit Mitte 2003 Erkrankungen bei Geflügel und seit Ende 2005 Erkrankungen beim Menschen an die WHO gemeldet, jedoch waren bereits im Februar 2003 drei Menschen aus Hongkong nach einem Besuch in der chinesischen Provinz Fujian an einer H5N1-Infektion erkrankt. Im Juni 2006 berichteten acht Experten in einem Schreiben an die Fachzeitschrift New England Journal of Medicine, dass in China bereits im November 2003 ein 24-jähriger Mann nachweislich an den Folgen einer H5N1-Infektion verstorben war.[65] Außerdem werden bisher in China nur dann Tests auf H5N1 durchgeführt, wenn es in unmittelbarer Nähe der Erkrankten auch zu Ausbrüchen mit erkennbaren Symptomen unter Tieren gekommen ist; in Südchina ist A/H5N1 jedoch seit mindestens 2004 auch in 2 von 100 Stück Schlachtgeflügel aus symptomlosen Tierbeständen nachweisbar.[66] Die bislang einzige aus Amerika berichtete Infektion war in der Volksrepublik China erworben worden.[67]
Besonders hoch war zeitweise (2014/2015) die Anzahl der Neuerkrankungen in Ägypten.[68]
Bis Mai 2015 waren der WHO weltweit 840 Erkrankungen und 447 Todesfälle gemeldet worden.[69] In den folgenden Jahren erhöhten sich diese Fallzahlen nur noch geringfügig.
Für die wiederholten Ausbrüche der Krankheit seit 2003 wies die Statistik der Weltgesundheitsorganisation am 19. Juli 2024 folgende bestätigte Erkrankungsfälle bei Menschen aus:[70][71]
| Land | Erkrankungen | Todesfälle |
|---|---|---|
| Australien | 1 | 0 |
| Ägypten | 359 | 120 |
| Aserbaidschan | 8 | 5 |
| Bangladesch | 8 | 1 |
| Chile[72] | 1 | 0 |
| Volksrepublik China | 56 | 32 |
| Dschibuti | 1 | 0 |
| Ecuador | 1 | 0 |
| Indien | 1 | 1 |
| Indonesien | 200 | 168 |
| Irak | 3 | 2 |
| Kanada[67] | 1 | 1 |
| Kambodscha | 69 | 42 |
| Laos | 3 | 2 |
| Myanmar | 1 | 0 |
| Nepal[73] | 1 | 1 |
| Nigeria | 1 | 1 |
| Pakistan | 3 | 1 |
| Spanien[74] | 2 | 0 |
| Thailand | 25 | 17 |
| Türkei | 12 | 4 |
| Vereinigte Staaten[75] | 5 | 0 |
| Vereinigtes Königreich[76] | 5 | 0 |
| Vietnam | 129 | 65 |
| Gesamt | 896 | 463 |
Risikolage für Menschen
Das Risiko für Menschen, an einer H5N1-Infektion zu erkranken, wird von den Experten weltweit als äußerst gering eingeschätzt. Insbesondere die Zahl der von der WHO registrierten Todesfälle muss im Verhältnis zum Risiko, an den Folgen einer „gewöhnlichen Humaninfluenza“ (echten Virusgrippe) zu sterben, betrachtet werden. Laut amtlicher deutscher Todesursachenstatistik sterben pro Jahr allein in Deutschland bis zu 20.000 Menschen an den Folgen einer Infektion mit Humaninfluenza-Viren.
Seit 2006 hat die WHO dem Erreger A/H5N1 unverändert die Pandemie-Warnstufe Alert phase („Alarmphase“) zugeordnet (bis Juni 2013: Pandemie-Warnstufe 3), die dadurch definiert ist, dass ein neuer Influenza-Subtyp in seltenen Einzelfällen von Mensch zu Mensch übertragen wird;[77] diese Zuordnung blieb auch im Jahr 2009 nach dem Auftreten der so genannten Schweinegrippe (Influenza-A-Virus H1N1) bestehen.
Viele Experten befürchten allerdings, das Vogelgrippevirus könne sich mit einem Erreger der Humangrippe kreuzen. Dies wäre prinzipiell möglich, wenn zum Beispiel Schweine, Geflügel oder Menschen gleichzeitig mit A/H5N1 und einem Erreger der Humangrippe (zumeist A/H1N1 oder A/H3N2) infiziert sind. Auf diese Weise könnte ein neuer Virussubtyp mit veränderten Eigenschaften entstehen. Denkbar wäre dann, dass dieser neue Virustyp leichter von Tier zu Mensch oder gar von Mensch zu Mensch übergehen könnte. Da zum Beispiel auch in Enten der Subtyp Influenza A/H1N1 nachgewiesen wurde, u. a. A/Duck/Alberta/35/76 (H1N1), muss auch Geflügel als potentielle Quelle für einen Genaustausch von Vogelgrippe- und Humangrippeviren gelten.[78]
Als grundsätzlich möglich gilt aber auch ein massiver unmittelbarer Übergang von Influenzaviren der Vögel auf den Menschen, sofern es bei den Viren zuvor zu bestimmten Veränderungen in ihren Erbanlagen gekommen ist. Gestützt wird diese Befürchtung durch Ergebnisse US-amerikanischer Forscher, die im Herbst 2005 den Erreger der spanischen Grippe A/H1N1 rekonstruierten. Die Erkenntnisse der Wissenschaftler legten nahe, dass das von ihnen rekonstruierte Influenzavirus A/H1N1 unmittelbar von einem Vogelgrippe-Virus abstammte und die Fähigkeit entwickelte, den Menschen zu befallen. Die Spanische Grippe sprang diesen Forschern zufolge also nicht nach einer Reassortierung („Kreuzung“) mit Humangrippeviren über, sondern nach wenigen (ca. 10) Mutationen. Seitdem das bekannt wurde, wird das Risiko für eine neuerliche Influenzapandemie deutlich höher eingestuft.[79] So erklärte beispielsweise Reinhard Kurth, der Präsident des Robert Koch-Instituts, am 18. August 2005 in der FAZ: „Die Gefahr einer Pandemie ist real und das Risiko derzeit so hoch wie seit Jahrzehnten nicht mehr.“ Im Januar 2006 ergänzte Kurth: „Das Virus mutiert sehr schnell.“ Das Institut geht Kurth zufolge in seinen Planungen für den Pandemie-Fall davon aus, dass bei mittelschwerer Virulenz des Erregers ca. 30 Prozent der Bevölkerung an der Virusgrippe erkranken.
Ende März 2006 wurde in der Fachzeitschrift Nature eine Untersuchung von japanischen und amerikanischen Wissenschaftlern um Kyoko Shinya von der University of Wisconsin in Madison, USA, veröffentlicht, die erklären soll, warum bisher die Übertragung von Mensch zu Mensch noch nicht auftritt. Anders als herkömmliche Grippeviren, die sich in den oberen Atemwegen festsetzen, befällt das aggressive Vogelgrippevirus vor allem die unteren Atemwege. Es nistet sich dabei in den Lungenbläschen ein. Eine Verbreitung des Virus von Mensch zu Mensch durch Husten oder Niesen würde dadurch erschwert, obwohl sich der Erreger in der menschlichen Lunge gut vermehren könne. Sollten die Viren die Fähigkeit erlangen, die oberen Atemwege zu besiedeln, würde die Wahrscheinlichkeit einer Pandemie zunehmen können.
Empfehlungen zum Infektionsschutz
Das deutsche Bundesamt für Bevölkerungsschutz und Katastrophenhilfe (BBK) hat beispielsweise bereits 2006 auf seiner Internetseite Empfehlungen für Einsatzkräfte veröffentlicht, die mit der Beseitigung infizierter Tiere befasst sind.[80] Darin werden u. a. Informationen zum Selbstschutz beim Umgang mit infektiösen Tieren oder Tierkadavern sowie zur erforderliche Schutzausstattung gegeben. Komme es trotz aller Vorsichtsmaßnahmen zu einem direkten Kontakt mit einem infizierten Tier oder mit dessen Ausscheidungen, sollten einer Empfehlung des Robert Koch-Instituts zufolge „die Hände gründlich mit Wasser und Seife gewaschen werden und verschmutzte Kleidungsstücke in der Waschmaschine gereinigt werden. Auch wenn das Risiko einer Vogelgrippeerkrankung extrem gering ist, sollte bei Grippesymptomen ein Arzt zu Rate gezogen werden.“
Die deutsche Bundesanstalt für Arbeitsschutz und Arbeitsmedizin hat zudem durch Beschluss 608 des Ausschusses für biologische Arbeitsstoffe eine „Empfehlung spezieller Maßnahmen zum Schutz der Beschäftigten vor Infektionen durch hochpathogene aviäre Influenzaviren“ veröffentlicht[81] und empfiehlt darin u. a. „partikelfiltrierende Halbmasken FFP3“ (entspricht in den USA NIOSH N99[82]) für medizinisches Personal während der Untersuchung von Erkrankten; bei geringerem Risiko einer Aerosolbelastung (Tröpfcheninfektion) genügen auch Halbmasken vom Typ FFP2 (USA: NIOSH N95) oder FFP1, die nicht von mehreren Personen benutzt und nach einmaligem Gebrauch entsorgt werden sollen. Der Pharmazeutischen Zeitung zufolge garantieren diese Masken „bei korrektem Gebrauch im Gegensatz zu den meisten OP-Masken einen dichten Sitz“;[83] empfohlen wird zugleich, dass auch der Mund-Nasen-Schutz für Erkrankte den Anforderungen der Geräteklasse FFP1 nach DIN EN 149 entsprechen sollte. Das Robert Koch-Institut hat ferner Empfehlungen herausgegeben, falls das Virus tatsächlich massiv auf den Menschen übertreten sollte.[2]
Empfehlungen für den Umgang mit Geflügelfleisch
Weltweit ist bisher keine einzige Erkrankung an H5N1-Viren durch kontaminierte Lebensmittel bekannt geworden. Insbesondere in Westeuropa kann davon ausgegangen werden, dass bisher auch keine kontaminierten Geflügelprodukte in den Handel gekommen sind. Zusätzliche Vorsicht beim Umgang mit Lebensmitteln, die über die ohnehin erforderliche Hygiene zum Schutz vor Salmonellose hinausgeht, wird (Stand 2006) von keiner amtlichen Stelle empfohlen. In Experimenten wurde die hochpathogene Variante des Vogel-Influenzavirus H5N1 bereits nach einer Sekunde bei 70 °C in Hühnchenbrust und -schenkelfleisch inaktiviert.[84]
Für Auslandsreisen empfahl das deutsche Auswärtig Amt: In Gebieten, in denen A/H5N1 verbreitet ist, sollten Geflügelfleisch und Eier stets vor dem Verzehr bis in den Kern über 70 °C erhitzt werden; konkret bedeutet das: Eier 10 Minuten kochen, Geflügelfleisch muss auch im Inneren eindeutig durchgegart, also an keiner Stelle mehr rötlich sein.[85] In diesen Gebieten sollte man Kontakt mit möglicherweise erkrankten Tieren vermeiden und keine Vogel- oder Geflügelmärkte besuchen.
Impfungen
Generell gilt: Damit eine prophylaktische Impfung sicher gegen ein Virus zu wirken vermag, müssen insbesondere dessen Oberflächenproteine bekannt sein. Sollte das derzeit zirkulierende H5N1-Virus mutieren und deshalb vermehrt von Mensch zu Mensch übergehen können, wäre diese neue Eigenschaft wahrscheinlich gerade auf veränderte Oberflächenproteine zurückzuführen. Die Herstellung und Zulassung eines an das veränderte Virus angepassten Impfstoffes könnte daher erst nach Bekanntwerden der Veränderungen, also nach Beginn der verstärkten Mensch-zu-Mensch-Übertragungen beginnen.
Im Februar 2006 gaben die deutschen Gesundheitsminister nach einer Konferenz bekannt, dass mit der deutschen Arzneimittelindustrie Absprachen über die rasche Herstellung von 160 Millionen Impfstoff-Einheiten getroffen wurden, d. h. über zwei Einheiten pro Bundesbürger, falls es zu einer Pandemie kommen sollte. Basierend auf diesen Absprachen wurde 2009 rasch ein Impfstoff gegen die Schweinegrippe produziert.
Obwohl ein verlässlicher Impfstoff gegen den Erreger einer Pandemie also erst hergestellt werden kann, wenn der Ernstfall schon eingetreten ist, entwickelten seit ca. 2007/2008 diverse Forschergruppen anhand der bereits bekannten Varianten des H5N1-Erregers als Zwischenlösung so genannte Prototyp- oder Modell-Impfstoffe (auch Mock-up-File genannt). Man erhoffte sich hiervon, dass die Erfahrungen im Umgang mit den Viren dazu führen, im Fall einer Pandemie rasch auch einen Impfstoff gegen den Pandemie-Erreger herstellen zu können. Man hoffte ebenfalls, dass auch ein unvollkommener Impfstoff eine gewisse immunologische Wirkung zeigen könnte und so genannte Kreuzreaktionen gegen die dann aktuelle H5N1-Variante auslösen könnte. In Tierversuchen wurde dieser „Kreuzschutz“ wiederholt nachgewiesen;[86] ob dies eine Erfolg versprechende Strategie sein würde, war umstritten. Der spätestens seit Sommer 2006 in Südchina unter Geflügel vorherrschende H5N1-Subtyp des Fujian-Stammes wird laut Hongkonger Forschern beispielsweise nicht durch jene Antikörper erkannt, die auf den 2004 in Vietnam isolierten H5N1-Stamm ansprechen, den die Arzneimittelfirmen als Basis ihrer Impfstoffentwicklung genommen haben.[87]
Eine herkömmliche Grippeimpfung gegen die „echte Grippe“ (Influenza) schützt nicht vor dem Virus A/H5N1, dennoch gibt es die Empfehlung vieler Experten, sich gegen Influenza impfen zu lassen. Dies gilt insbesondere dann, wenn man in H5N1-gefährdete Gebiete reist. Eine Grippeimpfung kann in der Regel eine Vermehrung der bekannten menschlichen Grippeviren unterbinden. So kann eine gleichzeitige Infektion mit beiden Grippesubtypen verhindert werden und damit eine mögliche „Kreuzung“ eines menschlichen Grippevirus mit A/H5N1. Eine solche Neukombination könnte das Risiko für Übergänge der Viren von Mensch zu Mensch stark erhöhen und zum Ausgangspunkt einer Pandemie werden.
Besonders für Kleinkinder und für Erwachsene ab 65 Jahren kann ferner eine Impfung gegen Pneumokokken sinnvoll sein. Diese Bakterien sind häufig verantwortlich für die einer Virusinfektion unmittelbar folgende Lungenentzündung: Wer sich mit einem Influenza-Virus infiziert und in der Folge stirbt, stirbt normalerweise nicht unmittelbar durch die Viren, sondern an einer Sekundärinfektion; diese wird häufig durch Pneumokokken hervorgerufen.
Allerdings gibt es aus Asien Berichte, dass viele an A/H5N1 Erkrankte eine akute Entzündung der unteren Lungenlappen entwickelten, die unmittelbar vom Virus verursacht wurde. Zwei vietnamesische Kinder sollen überdies an einer Enzephalitis gestorben sein, ohne zuvor Anzeichen einer Erkrankung der Atemwege gezeigt zu haben.
Symptome beim Menschen
Die Inkubationszeit des Virus A/H5N1 scheint länger als die 2 bis 3 Tage zu sein, die bei der „normalen“ Humangrippe zu beobachten sind. Von der Weltgesundheitsorganisation veröffentlichte Daten besagen, dass die Inkubationszeit zwischen 2 und 8 Tagen liegt; allerdings sind auch Fälle mit 17 Tagen Inkubationszeit beschrieben worden. Die WHO empfiehlt, im Rahmen von epidemiologischen Studien eine Inkubationszeit von 7 Tagen zu unterstellen. Viele Patienten mit einer H5N1-Infektion entwickelten schon in einem frühen Stadium eine Lungenentzündung.[88]
Nach Krankheitsbeginn sind regelmäßig zunächst folgende grippeähnliche Anzeichen beobachtet worden (siehe Influenza):
- extrem hohes Fieber
- Husten
- Atemnot
- Halsschmerzen
Teils auch Durchfall, seltener Bauchschmerzen und Erbrechen.
Im weiteren Krankheitsverlauf sehr oft:
- Lungenentzündung (Pneumonie)
- Magenbeschwerden
- Darmbeschwerden
- Erhöhung der Leberwerte
- starke Verminderung der Leukozyten (Leukopenie)
- starke Verminderung der Erythrozyten (Anämie)
- starke Verminderung der Thrombozyten (Thrombozytopenie)
Gelegentlich entwickelten Patienten zusätzlich eine Nierenschwäche, die sich später bis hin zum kompletten Nierenversagen steigerte. Häufig erlitten sie ein tödliches Lungenversagen oder starben an einem Multiorganversagen. Die relativ hohe Todesrate ist bei neuartigen Viruserkrankungen nicht ungewöhnlich und erklärt sich u. a. dadurch, dass dieses Virus noch nicht an den Menschen angepasst ist (und daher seinen Wirt rasch umbringt, statt ihn als „Werkzeug“ zur Weiterverbreitung zu nutzen) und dass der Mensch keine Abwehrkräfte gegen diesen Virussubtyp besitzt.
Einer Hongkonger Forschergruppe zufolge setzen die Viren vor allem in der Lunge bestimmte entzündungsfördernde Stoffe (Zytokine, speziell Interleukin-6) frei, die ganz allgemein die Immunantwort des Körpers gegen eingedrungene Erreger aktivieren. Die H5N1-Viren setzen drei- bis fünfmal so viele Cytokine frei wie von Humangrippeviren. Dieser Zytokinsturm[89] kann rasch zu einem schweren toxischen Schock und zu Multiorganversagen führen.[90]
Behandlung beim Menschen
Die WHO hat im Juni 2006 Richtlinien zur medikamentösen Behandlung von H5N1-Patienten veröffentlicht.[91] Bei erkrankten Menschen können im Frühstadium der Krankheit die antiviralen Neuraminidase-Hemmer Oseltamivir (Handelsname Tamiflu®) zur Einnahme oder Zanamivir (Handelsname Relenza®) zur Inhalation helfen, es sei denn H5N1 ist gegen diese Medikamente resistent.
Eine im September 2007 veröffentlichte australische Studie untersuchte mehrere Isolate der zwei kursierenden HPAI-Stämme aus den Jahren 2004 und 2005. Gemäß dieser Studie entspricht die Empfindlichkeit beider Stämme gegen Zanamivir etwa der Empfindlichkeit von A/H1N1-Referenzstämmen. Gegen Oseltamivir ist die Empfindlichkeit des in Vietnam, Kambodscha und Thailand dominanten Stamms nach diesen Ergebnissen um Faktor 6–7 zurückgegangen, die Empfindlichkeit des zweiten, indonesischen, Stamms hingegen um Faktor 15–30. Die Forscher vermuten Antigendrift als Ursache der zunehmenden Unempfindlichkeit.[92]
Meldepflicht beim Menschen
In Deutschland ist eine „zoonotische Influenza“ eine meldepflichtige Krankheit nach § 6 Absatz 1 des Infektionsschutzgesetzes. Die namentliche Meldepflicht besteht bei Verdacht, Erkrankung und Tod. Meldepflichtig ist die zoonotische Influenza nach dem Recht Deutschlands durch das Masernschutzgesetz seit dem 1. März 2020.[93]
In Österreich sind „Infektionen mit dem Influenzavirus A/H5N1 oder einem anderen Vogelgrippevirus“ anzeigepflichtige Krankheiten gemäß § 1 Abs. 1 Epidemiegesetz 1950. Die Meldepflicht bezieht sich auf Verdachts-, Erkrankungs- und Todesfälle.
In der Schweiz ist eine „Influenza A HxNy (neuer Subtyp)“ eine meldepflichtige Krankheit und zwar nach dem Epidemiengesetz (EpG) in Verbindung mit der Epidemienverordnung und Anhang 1 der Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen. Die Pflicht besteht bei klinischem Verdacht und erstreckt sich auch auf die Rücksprache mit Fachärztin oder Facharzt für Infektiologie und die Veranlassung einer erregerspezifischen Labordiagnostik.
Krisenpläne für den Fall einer Pandemie
In vielen Staaten wurden nationale Krisenpläne für den Fall eines massiven Übergangs von Geflügelpest-Viren auf Menschen erarbeitet. Die Weltgesundheitsorganisation entsendet in Gebiete, in denen H5N1-Erkrankungen beim Menschen aufgetreten sind oder vermutet werden, jeweils rasch Ermittler („Feld-Epidemiologen“). Diese versuchen mit oft erheblichem Aufwand, Übertragungswege und mögliche Veränderungen der Erbanlagen des Virus nachzuvollziehen. Zudem werden von vielen Staaten erhebliche Mengen von antiviralen Medikamenten bevorratet.
Siehe auch
Literatur
- Alan Sipress: The Fatal Strain: On the Trail of Avian Flu and the Coming Pandemic. Viking, 2009
- Michael Greger: Bird Flu. A Virus of Our Own Hatching. Lantern Books, New York 2006, ISBN 1-59056-098-1 (Volltext)
- Mike Davis: Vogelgrippe. Zur gesellschaftlichen Produktion von Epidemien. Assoziation A, Berlin 2005, ISBN 3-935936-42-7 (deutsche Fassung von: The Monster at our Door. The Global Thread of Avian Flu. The New Press, New York, London 2005, ISBN 1-59558-011-5)
Weblinks
Vorsorgemaßnahmen
- Schutz der Bevölkerung vor neu auftretenden Influenza-Viren. / Empfehlungen für Einsatzkräfte. ( vom 29. März 2020 im Internet Archive). Publiziert vom Deutschen Bundesamt für Bevölkerungsschutz und Katastrophenhilfe.
- Empfehlung spezieller Maßnahmen zum Schutz der Beschäftigten vor Infektionen durch hochpathogene aviäre Influenzaviren (Klassische Geflügelpest, Vogelgrippe). Beschluss des Ausschusses für Biologische Arbeitsstoffe 608, Stand: Februar 2007.
- Arbeitsschutz beim Auftreten einer nicht ausreichend impfpräventablen humanen Influenza. Beschluss des Ausschusses für Biologische Arbeitsstoffe 609, Stand: Juni 2012.
- Hygiene-Tipps für Haus und Küche. Bundesinstitut für Risikobewertung (BfR).
- Ausgewählte Fragen und Antworten zur Hygiene bei Lebensmitteln und Bedarfsgegenständen in Zeiten der Vogelgrippe – Bundesinstitut für Risikobewertung (BfR). 16. März 2022
Wichtige amtliche Quellen
Internationale Institutionen
- Weltgesundheitsorganisation (WHO): Global Influenza Programme. (auf Englisch)
- Weltorganisation für Tiergesundheit (OIE): Avian Influenza. (auf Englisch)
- Welternährungsorganisation (FAO): Basic advice for stopping the spread of avian influenza. (auf Englisch, pdf; 101 kB)
- European Scientific Working group on Influenza: aktuelle, wissenschaftsorientierte Informationen (auf Englisch)
In Deutschland
- Bundesministerium für Ernährung und Landwirtschaft: Informationen zu Geflügelpest/Vogelgrippe.
- Robert Koch-Institut: Zoonotische Influenza.
- Friedrich-Loeffler-Institut: Risikobewertung zur Einschleppung sowie zum Auftreten von hochpathogenem aviären Influenzavirus in Hausgeflügelbestände in der Bundesrepublik Deutschland. Stand: 3. Juni 2015 (PDF)
In Österreich
- Österreichischer Influenza Pandemieplan. Stand: September 2005.
In der Schweiz
- Bundesamt für Gesundheit: Influenza-Pandemieplan Schweiz 2018.
- Schweizer Bundesamt für Lebensmittelsicherheit und Veterinärwesen: Vogelgrippe beim Tier.
Weitere herausragende Seiten
- Hintergrundinformationen zur Vogelgrippe und Hinweise für Vogelkundler. (PDF, 827 KB). ( vom 24. Januar 2009 im Internet Archive). Im Original publiziert in: Vogelwarte. Zeitschrift für Vogelkunde. Band 43, 2005, S. 249–260.
- Foreign animal diseases, the grey book. ( vom 9. März 2013 im Internet Archive) Studie des Committee on Foreign Animal Diseases of the U.S. Animal Health Association aus dem Jahr 2008 (PDF; 4,6 MB)
- Fowl play. The poultry industry’s central role in the bird flu crisis. ( vom 15. Juli 2015 im Internet Archive) PDF, 430 kB. Agrarpolitische Hintergrundseite der NGO GRAIN, Barcelona, Februar 2006.
Materialien für die Schule
- learn-line.nrw.de: Hintergründe, Aktuelles und Statistiken im Bildungsserver NRW
- lernarchiv.bildung.hessen.de: frei zugängliche Materialien auf dem Bildungsserver Hessen
- ZUM-Wiki: Materialien zum Unterricht
- Historisches Dossier „Vogelgrippe“: agrarpolitische Hintergrundtexte und Länderberichte ( vom 9. August 2019 im Internet Archive). Im Original publiziert auf dem Server der Schweizer WOZ – Die Wochenzeitung in den Jahren 2005/2006.
Belege
- ↑ Weifeng Shi und George F. Gao: Emerging H5N8 avian influenza viruses. In: Science. Band 372, Nr. 6544, 2021, S. 784–786, doi:10.1126/science.abg6302.
- ↑ a b Empfehlungen des Robert Koch-Institutes zu Präventions- und Kontrollmaßnahmen bei Bewohnern mit Verdacht auf bzw. nachgewiesener Influenza in Heimen. Auf: rki.de, Stand: August 2010.
- ↑ Highly pathogenic H5N1 avian influenza outbreaks in poultry and in humans: Food safety implications. (PDF; 206 kB) ( vom 13. Februar 2009 im Internet Archive). Im Original publiziert von WHO und FAO auf who.int vom 4. November 2005.
- ↑ Geflügelpest / Aviäre Influenza. ( vom 13. März 2014 im Internet Archive) Merkblatt des Schweizer Bundesamtes für Veterinärwesen (BVET), Stand 03/2011.
- ↑ In: New Scientist vom 13. Mai 2006, S. 39.
- ↑ In: Science. Band 312 vom 9. Juni 2006, S. 1451.
- ↑ Avian Influenza in Birds. Auf: cdc.gov, zuletzt abgerufen am 5. April 2022. Wörtlich heißt es hier: „Wild aquatic birds can be infected with avian influenza A viruses in their intestines and respiratory tract, but some species, such as ducks, may not get sick.“
- ↑ Noriyuki Yamaguchi et al.: Satellite-tracking of Northern Pintail Anas acuta during outbreaks of the H5N1 virus in Japan: implications for virus spread. In: Ibis. Band 152, Nr. 2, S. 262–271, doi:10.1111/j.1474-919X.2010.01010.x.
- ↑ Qiqi Yang, Xiang Zhao et al.: Assessing the role of live poultry trade in community-structured transmission of avian influenza in China. In: PNAS. Band 117, Nr. 11, 2020, S. 5949–5954, doi:10.1073/pnas.1906954117.
Avian influenza and live poultry trade in China. Auf: eurekalert.org vom 2. März 2020. - ↑ FLI aktualisiert die Risikoeinschätzung zur Ausbreitung von HPAI-H5
- ↑ siehe auch dpa/AFP vom 21. September 2022: Fachmann sieht „ganz neue Qualität“ bei Vogelgrippe
- ↑ In: Science. Band 311 vom 3. März 2006, S. 1225.
- ↑ laut New Scientist vom 19. Mai 2007, S. 12.
- ↑ Chairul A. Nidom et al.: Influenza A (H5N1) Viruses from Pigs, Indonesia. In: Emerging Infectious Diseases. Band 16, Nr. 10, 2010, doi:10.3201/eid1610.100508.
- ↑ David Cyranoski: Bird flu data languish in Chinese journals. In: Nature. Band 430, Nr. 7003, 2004, S. 955, doi:10.1038/430955a.
- ↑ Första fallet av fågelinfluensa bekräftad hos tumlare. Auf der Website von Statens veterinärmedicinska anstalt (sva.se) vom 31. August 2022.
- ↑ Federal and State Veterinary, Public Health Agencies Share Update on HPAI Detection in Kansas, Texas Dairy Herds. Mitteilung des Animal and Plant Health Inspection Service des U.S. Department of Agriculture vom 25. März 2024.
Highly Pathogenic Avian Influenza A (H5N1) Virus Infection Reported in a Person in the U.S. Mitteilung der Centers for Disease Control and Prevention vom 1. April 2024. - ↑ Avian Influenza A(H5N1) – United States of America. Disease Outbreak News auf who.int vom 9. April 2024.
- ↑ CDC Reports Second Human Case of H5 Bird Flu Tied to Dairy Cow Outbreak. Auf: cdc.gov vom 22. Mai 2024.
- ↑ Leonardo C. Caserta et al.: Spillover of highly pathogenic avian influenza H5N1 virus to dairy cattle. In: Nature. Band 634, 2024, S. 669–676, doi:10.1038/s41586-024-07849-4.
- ↑ a b c d e Marco Evers: (S+) Vogelgrippe H5N1: US-Behörden scheitern an Aufklärung – droht jetzt eine neue Pandemie? In: Der Spiegel. 1. Juli 2024, ISSN 2195-1349 (spiegel.de [abgerufen am 1. Juli 2024]).
- ↑ Update on Hyghly Pathogenic Avian Influenza in Animals (Type H5 and H7). ( vom 23. Februar 2009 im Internet Archive) Übersicht zu den Erkrankungen von Wild- und Hausgeflügel. Auf: oie.int vom 16. Oktober 2010.
- ↑ „Poultry trading is the primary means of spreading the virus.“ So ein Zitat von Scott Newman, Experte für Tiergesundheit bei der FAO, zitiert in: Science. Band 319, 2008, S. 1178.
- ↑ Sievert Lorenzen: Evolution und Ausbreitung des Vogelgrippe-Virus H5N1 Asia sowie Aspekte der Biosicherheit. In: Tierärztliche Umschau. Band 63, 2008, S. 333–339, Volltext (PDF; 125 kB).
- ↑ Kam die Vogelgrippe per Lkw aus Ungarn? Britische Putenfarm kurz vor Seuchen-Ausbruch beliefert. ( vom 27. September 2012 im Internet Archive) NABU, 12. Februar 2007.
- ↑ In: New Scientist vom 13. Mai 2006, S. 41.
- ↑ In: Science. Band 319, 2008, S. 1178.
- ↑ In: Science. Band 312, 12. Mai 2006, S. 845.
- ↑ Why unprecedented bird flu outbreaks sweeping the world are concerning scientists. Auf: nature.com vom 26. Mai 2022.
- ↑ ‘Incredibly concerning’: Bird flu outbreak at Spanish mink farm triggers pandemic fears. Auf: science.org vom 24. Januar 2023.
Montserrat Agüero et al.: Highly pathogenic avian influenza A(H5N1) virus infection in farmed minks, Spain, October 2022. In: Euro Surveillance. Band 28, Nr. 3, 2023, doi:10.2807/1560-7917.ES.2023.28.3.2300001. - ↑ Immediate notification report (Ref OIE:7695). Auf: oie.int vom 16. Januar 2008 (PDF; 19 kB).
- ↑ Immediate notification report. REF OIE 13447, Report Date: 13/05/2013, Country: Korea (Dem. People's Rep.) ( vom 16. Juli 2015 im Internet Archive) (PDF; 48 kB) Auf: oie.int vom 13. Mai 2013.
- ↑ Follow-up report No. 8. Reference OIE: 13510. ( vom 9. Juli 2014 im Internet Archive) (PDF; 84 kB) Auf: oie.int vom 26. Mai 2013.
- ↑ OIE: Weekly Disease Information, Band 20, Nr. 8 vom 22. Februar 2007.
- ↑ FLI: Ungekürzte Risikoeinschätzung zum Auftreten von HPAIV H5 in Deutschland, Stand 26.10.2021. (PDF, barrierefrei)
- ↑ Vogelgrippe: Fallzahlen in Europa so hoch wie noch nie im Sommer. Europäische Behörde für Lebensmittelsicherheit (EFSA) vom 3. Oktober 2022.
- ↑ Ausbruch der Vogelgrippe im Zoo Berlin. In: zoo-berlin.de. 18. November 2022, abgerufen am 19. November 2022.
- ↑ Schweizweite Massnahmen zur Bekämpfung der Vogelgrippe angeordnet. In: blv.admin.ch. Bundesamt für Lebensmittelsicherheit und Veterinärwesen, 24. November 2022, abgerufen am 15. Februar 2023.
- ↑ Vorbeugende Massnahmen gegen Vogelgrippe verlängert. In: blv.admin.ch. Bundesamt für Lebensmittelsicherheit und Veterinärwesen, 2. Februar 2023, abgerufen am 15. Februar 2023.
- ↑ Vorbeugende Massnahmen gegen Vogelgrippe erneut verlängert. In: blv.admin.ch. Bundesamt für Lebensmittelsicherheit und Veterinärwesen, 9. März 2023, abgerufen am 11. März 2023.
- ↑ Vogelgrippe: Massnahmen per 1. Mai 2023 aufgehoben. In: blv.admin.ch. Bundesamt für Lebensmittelsicherheit und Veterinärwesen, 27. April 2023, abgerufen am 7. Mai 2023.
- ↑ Lokale Massnahmen gegen die Vogelgrippe. In: blv.admin.ch. Bundesamt für Lebensmittelsicherheit und Veterinärwesen, 25. Mai 2023, abgerufen am 28. August 2023.
- ↑ Vogelgrippe: Lokale Massnahmen bis 15. Oktober verlängert. In: blv.admin.ch. Bundesamt für Lebensmittelsicherheit und Veterinärwesen, 26. Juli 2023, abgerufen am 28. August 2023.
- ↑ In: Süddeutsche Zeitung. Nr. 153 vom 6. Juli 2006, S. 18.
- ↑ OIE: Immediate notification report. ( vom 21. Januar 2015 im Internet Archive) vom 20. Januar 2015, REF OIE 17014, Report Date: 20/01/2015, Country :United States of America.
- ↑ Report reference: REF OIE 16771, Report Date: 16/12/2014, Country: United States of America. ( vom 17. Dezember 2014 im Internet Archive) Auf: oie.int, 16. Dezember 2014.
- ↑ OIE: Report vom 15. April 2015. ( vom 17. April 2015 im Internet Archive), Information received on 15/04/2015 from Dr John Clifford, Deputy Administrator, Animal and Plant Health Inspection Service, United States Department of Agriculture, Washington.
- ↑ Report reference: CAN-2015-NAI-001 REF OIE 17152, Report Date: 06/02/2015, Country: Canada. ( vom 9. Februar 2015 im Internet Archive) Auf: oie.int, 7. Februar 2015.
- ↑ Bird flu is killing millions of chickens and turkeys across the US. Auf: theconversation.com vom 7. April 2022.
- ↑ Record avian flu outbreak is threatening North America’s birds. Is the virus here to stay? Auf: science.org vom 26. April 2022.
- ↑ Anika Freier: Mutiertes Virus: Warum die Vogelgrippe verstärkt auf Säugetiere und Menschen überspringt. In: Der Spiegel. 10. Juli 2024, ISSN 2195-1349 (spiegel.de [abgerufen am 10. Juli 2024]).
- ↑ Vogelgrippe hat Antarktis erreicht. In: Der Spiegel. 28. Februar 2024, ISSN 2195-1349 (spiegel.de [abgerufen am 28. Februar 2024]).
- ↑ Thomas C. Mettenleiter, Elke Reinking: Tiergesundheit geht auch den Menschen an. Beispiel Vogelgrippe. In: Forschungsreport. Nr. 1/2008, S. 12. Braunschweig, ISSN 1863-771X.
- ↑ Vincent J. Munster et al.: Spatial, Temporal, and Species Variation in Prevalence of Influenza A Viruses in Wild Migratory Birds. In: PLoS Pathog. Band 3, Nr. 5: e61, doi:10.1371/journal.ppat.0030061.
- ↑ Neuer Impfstoff gegen Vogelgrippe entwickelt. Auf: taz.de vom 28. Dezember 2005.
- ↑ Seyed Davoud Jazayeri und Chit Laa Poh: Recent advances in delivery of veterinary DNA vaccines against avian pathogens. In: Veterinary Research. Band 50, Nr. 1, 10. Oktober 2019, S. 78, doi:10.1186/s13567-019-0698-z, PMID 31601266, PMC 6785882 (freier Volltext).
- ↑ In: FAZ. Nr. 254 vom 1. November 2006, S. N1 (Natur und Wissenschaft), basierend auf Auskünften von Robert Webster, St. Jude Children’s Research Hospital, Memphis, Tennessee.
- ↑ In: New Scientist vom 4. November 2006, S. 8 f.
- ↑ G. J. D. Smith et al.: Emergence and predominance of an H5N1 influenza variant in China. In: PNAS. Band 103, Nr. 45, 2006, S. 16936–16941, doi:10.1073/pnas.0608157103. Bei den Kontrolluntersuchungen zwischen Juni 2005 und Juni 2006 wiesen 3,5 % der Gänse, 3,3 % der Enten und 0,5 % der Hühner H5N1-Befall auf; insgesamt hatte man 53.220 Tiere getestet.
- ↑ RKI – Zoonotische Influenza – RKI zu humanen Erkrankungen mit aviärer Influenza (Vogelgrippe). Abgerufen am 6. Juni 2024. (aktualisiert am 6. Juni 2024)
- ↑ Maria D. Van Kerkhove et al.: Highly Pathogenic Avian Influenza (H5N1): Pathways of Exposure at the Animal‐Human Interface, a Systematic Review. In: PLoS ONE. Band 6, Nr. 1: e14582, 2011, doi:10.1371/journal.pone.0014582.
- ↑ Martin Enserink: Controversial Studies Give a Deadly Flu Virus Wings. In: Science. Band 334, Nr. 6060, 2011, S. 1192–1193, doi:10.1126/science.334.6060.1192.
- ↑ Richard Stone: Combating the Bird Flu Menace, Down on the Farm. In: Science. Band 311, 2006, S. 945, doi:10.1126/science.311.5763.944.
- ↑ Declan Butler: Pandemic ‚dry run‘ is cause for concern. In: Nature. Band 441, 2006, S. 554–555, doi:10.1038/441554a.
- ↑ In: The New England Journal of Medicine. Band 354, S. 2731 f. vom 22. Juni 2006.
- ↑ H. Chen et al.: Establishment of multiple sublineages of H5N1 influenza virus in Asia: Implications for pandemic control. In: PNAS. Band 103, 2006, S. 2845–2850; doi:10.1073/pnas.0511120103.
- ↑ a b First Human Avian Influenza A (H5N1) Virus Infection Reported in Americas. ( vom 10. Januar 2014 im Internet Archive). Im Original publiziert auf cdc.gov vom 8. Januar 2014.
- ↑ Egypt: upsurge in H5N1 human and poultry cases but no change in transmission pattern of infection. Auf: emro.who.int vom 15. Mai 2015.
- ↑ Cumulative number of confirmed human cases for avian influenza A(H5N1) reported to WHO, 2003-2015. ( vom 21. Mai 2015 im Internet Archive). Im Original publiziert auf who.int vom 1. Mai 2015.
- ↑ Cumulative number of confirmed human cases for avian influenza A(H5N1) reported to WHO, 2003-2024. Auf: cdn.who.int vom 19. Juli 2024.
- ↑ Siehe auch: WHO: Disease Outbreak News. und WHO: Global Influenza Programme.
Global Influenza Programme: Latest summary and risk assessment. Auf: who.org. - ↑ Human Infection caused by Avian Influenza A (H5N1) – Chile. Disease Outbreak News auf: who.int vom 21. April 2023.
- ↑ Information on Avian Influenza A (H5N1) Identified in Human in Nepal. ( vom 6. Mai 2019 im Internet Archive) Publiziert auf searo.who.int vom 2. Mai 2019.
- ↑ Avian Influenza A (H5N1) – Spain. Auf: who.int vom 3. November 2022-
- ↑ Laut CDC wurden mit Stand vom 6. September 2024 bereits 14 Infizierte in den USA nachgewiesen.
- ↑ Influenza A (H5) – United Kingdom of Great Britain and Northern Ireland Auf: who.int vom 14. Januar 2022.
- ↑ Current WHO global phase of pandemic alert: Avian Influenza A(H5N1). ( vom 1. Juni 2018 im Internet Archive) Ursprünglich abgerufen am 15. Juli 2015.
- ↑ Jeffery Taubenberger et al.: Initial Genetic Characterization of the 1918 „Spanish“ Influenza Virus. In: Science. Band 275, 1997, S. 1793–1796; doi:10.1126/science.275.5307.1793.
- ↑ Todbringende Vögel. Die Vogelgrippe sprang schon 1918 ziemlich direkt auf den Menschen über. Auf: heise.de vom 7. Oktober 2005.
- ↑ Vogelgrippe – Information für Einsatzkräfte. (PDF) Deutsches Bundesamt für Bevölkerungsschutz und Katastrophenhilfe, Stand: 24. Februar 2006.
- ↑ Empfehlung spezieller Maßnahmen zum Schutz der Beschäftigten vor Infektionen durch hochpathogene aviäre Influenzaviren. Beschluss 608 der deutschen Bundesanstalt für Arbeitsschutz und Arbeitsmedizin; Stand: 13. Februar 2007.
- ↑ NIOSH-Approved Disposable Particulate Respirators (Filtering Facepieces). ( vom 21. März 2006 im Internet Archive) Auf: cdc.gov/niosh, ursprünglich abgerufen am 11. Oktober 2012.
- ↑ Influenza-Pandemie: Maske ist nicht gleich Maske. Auf: pharmazeutische-zeitung.de, abgerufen am 11. Oktober 2012. Erläuternd heißt es hier: „Die FFP-Masken sind in drei Schutzstufen erhältlich, wobei FFP1-Filter mindestens 80 Prozent, FFP2-Filter 94 Prozent und FFP3-Filter 99 Prozent eines NaCl-Prüfaerosols zurückhalten müssen. Maximal darf beim Träger entsprechend 22, 8 beziehungsweise 2 Prozent des Aerosols ankommen.“
- ↑ P. De Benedictis, M. S. Beato und I. Capua: Inactivation of Avian Influenza Viruses by Chemical Agents and Physical Conditions: A Review. In: Zoonoses and Public Health. Band 54, 2007. S. 51–68, hier S. 55.
- ↑ WHO: Avian influenza: food safety issues. ( vom 19. Februar 2018 im Internet Archive)
- ↑ John J. Treanor, James D. Campbell, Kenneth M. Zangwill, Thomas Rowe und Mark Wolff: Safety and Immunogenicity of an Inactivated Subvirion Influenza A (H5N1) Vaccine. In: The New England Journal of Medicine. Band 354, Nr. 13, 2006, S. 1343–1351, doi:10.1056/NEJMoa055778.
- ↑ In: New Scientist vom 4. November 2006, S. 9.
- ↑ Avian influenza – Key facts. Auf: who.int, Stand: März 2014.
- ↑ J. R. Tisoncik, M. J. Korth u. a.: Into the eye of the cytokine storm. In: Microbiology and molecular biology reviews : MMBR. Band 76, Nummer 1, März 2012, S. 16–32, doi:10.1128/MMBR.05015-11, PMID 22390970, PMC 3294426 (freier Volltext) (Review).
- ↑ ähnliche Befunde wurden 2005/6 aus dem Hospital for Tropical Deseases, Ho Chi Minh Stadt, Vietnam berichtet: Menno de Jong et al.: Fatal outcome of human influenza A (H5N1) is associated with high viral load and hypercytokinemia. In: Nature Medicine. Band 12, 2006, S. 1203–1207, doi:10.1038/nm1477.
- ↑ WHO Rapid Advice Guidelines on pharmacological management of humans infected with avian influenza A (H5N1) virus. (PDF; 1,2 MB) ( vom 14. Februar 2007 im Internet Archive). Im Original publiziert auf who.int, Stand: 2006.
- ↑ J. L. McKimm-Breschkin et al.: Reduced Sensitivity of Influenza A (H5N1) to Oseltamivir. In: Emerging Infectious Diseases. Band 13, Nr. 9, 2007, S. 1354–1357, doi:10.3201/eid1309.07-0164, Volltext.
- ↑ Gesetz für den Schutz vor Masern und zur Stärkung der Impfprävention (Masernschutzgesetz). (PDF) Artikel 1 : Änderung des Infektionsschutzgesetzes. In: BGBl. I S. 148. 13. Februar 2020, abgerufen am 14. März 2020.