Ethanol
Das Ethanol (IUPAC) oder der Ethylalkohol,[15] auch Äthanol[16] oder Äthylalkohol, gemeinsprachlich auch (gewöhnlicher) Alkohol genannt,[17] ist ein aliphatischer, einwertiger, primärer Alkohol mit der Summenformel C2H6O.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
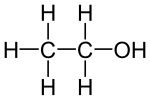
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Ethanol | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C2H6O | |||||||||||||||||||||
| Kurzbeschreibung |
klare, farblose, würzig riechende und brennend schmeckende, leichtentzündliche, hygroskopische[2] Flüssigkeit[2][3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 46,07 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
78,32 °C[2] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| pKS-Wert |
16[5] | |||||||||||||||||||||
| Löslichkeit |
beliebig mit Wasser, Diethylether, Chloroform, Benzin und Benzol mischbar[2] | |||||||||||||||||||||
| Brechungsindex |
1,3638[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK | ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Die reine Substanz ist eine bei Raumtemperatur farblose, leicht entzündliche Flüssigkeit mit einem brennenden Geschmack und einem charakteristischen, würzigen (süßlichen) Geruch. Die als Lebergift eingestufte Droge wird bei der Herstellung von Genussmitteln und alkoholischen Getränken wie Wein, Bier und Spirituosen aus kohlenhydrathaltigem Material durch eine von Hefen ausgelöste Gärung in großem Maßstab produziert.
Die Vergärung von Zucker zu Ethanol ist eine der ältesten bekannten biochemischen Reaktionen. Seit dem 19. Jahrhundert wird Ethanol für industrielle Zwecke aus Ethen hergestellt. Ethanol hat eine weite Verbreitung als Lösungsmittel für Stoffe, die für medizinische oder kosmetische Zwecke eingesetzt werden, wie Duftstoffe, Aromen, Farbstoffe oder Medikamente sowie als Desinfektionsmittel. Die chemische Industrie verwendet es sowohl als Lösungsmittel als auch als Ausgangsstoff für die Synthese weiterer Produkte wie Carbonsäureethylester.
Ethanol wird energetisch als Biokraftstoff, etwa als sogenanntes Bioethanol verwendet. Beispielsweise enthält der Ethanol-Kraftstoff E85 einen Ethanolanteil von 85 Volumenprozent.
Systematik
Ethanol (C2H5OH) gehört zu den linearen n-Alkanolen. Ethanol leitet sich von dem Alkan (gesättigten Kohlenwasserstoff) Ethan (C2H6) ab, in dem formal ein Wasserstoffatom durch die funktionelle Hydroxygruppe (–OH) ersetzt wurde. Zur Benennung wird dem Namen Ethan das Suffix -ol angehängt. Die Summenformel für Ethanol nach dem Hill-System ist C2H6O, die häufig verwendete Schreibweise C2H5OH ist keine Summen-, sondern eine Halbstrukturformel.
Alkohol ist das umgangssprachliche Wort für Ethanol; die Fachbezeichnung Alkohole hingegen steht für eine Gruppe organisch-chemischer Verbindungen, die neben dem Kohlenwasserstoffgerüst als zusätzliche funktionelle Gruppe mindestens eine Hydroxygruppe besitzen, wobei sich an dem Kohlenstoffatom mit der Hydroxygruppe kein höherwertiger Substituent befindet.
Geschichte
Ethanol entsteht auf natürlichem Weg vor allem bei der Vergärung zuckerhaltiger Früchte. Dem Menschen ist diese natürlich vorkommende Substanz seit langem als Mittel zur Berauschung (Rauschgift)[18] bekannt.[19][20] So finden sich in ägyptischen Schriftrollen der 3. Dynastie[21] sowie auf alt-mesopotamischen Keilschrifttafeln[21] Hinweise auf die Herstellung ethanolhaltiger Getränke.
Biere, später Weine wurden zunächst mit Hilfe von Wildhefen erzeugt. Die Ethanolgehalte solcher Getränke waren geringer als heute, da die Wildhefen ab einer bestimmten Ethanolkonzentration die Umwandlung von Zucker in Ethanol einstellen. Durch jahrhundertelange Züchtung tolerieren heutige Kulturhefen wie Saccharomyces cerevisiae höhere Ethanolgehalte.[22] Ethanol konzentriert zu gewinnen, gelang um 900 dem persischen Arzt, Naturwissenschaftler, Philosophen und Schriftsteller Abu Bakr Mohammad ibn Zakariya ar-Razi durch die Destillation von Wein.[23]
Auf ein Wort der arabischen Sprache (arabisch الكحول, DMG al-kuḥūl), geht die im 18. Jahrhundert nachweisbare Bezeichnung Alkohol für ‚Geist des Weines‘ zurück.
Bei Paracelsus, bei dem der Begriff alkool Ende der 1520er Jahre in Von den natürlichen Wassern ein ‚feines Pulver‘ bezeichnet, ist alcool vini oder alcohol vini 1526/1527 in Liber praeparationum Weingeist bzw. Ethanol[24] (durch Destillation aus Wein gewonnener Alkohol, der bei Redestillation bis zu 96 % Alkoholgehalt erreichen kann[25]). Eine solche destillatorische Trennung wurde im Frühmittelalter wohl auch schon in China[26] durchgeführt, war – wahrscheinlich über arabische Vermittlung – gegen 1100 in Salerno, wo um 1050 wohl erstmals reiner Alkohol destilliert[27] wurde, bekannt und wurde von Taddeo Alderotti[28] vor 1288 einer breiteren Öffentlichkeit in Europa bekanntgemacht.[29][30][31][32]
Im Jahr 1796 erhielt Johann Tobias Lowitz erstmals reines Ethanol durch Filtrierung von destilliertem Alkohol über Aktivkohle.[33] Damals war auch der heute noch verwendete Begriff Weingeist (früher auch sublimierter Wein, lateinisch vinum sublimatum, genannt[34]) für den reinen Alkohol üblich. Antoine Lavoisier beschrieb Ethanol erstmals als eine Verbindung aus Kohlenstoff, Wasserstoff und Sauerstoff. Im Jahr 1808 bestimmte Nicolas-Théodore de Saussure die chemische Zusammensetzung von Ethanol. Fünfzig Jahre später veröffentlichte Archibald Scott Couper die Strukturformel von Ethanol. Es war eine der ersten Strukturformeln, die bestimmt wurden.
Ethanol wurde zum ersten Mal synthetisch im Jahr 1826 durch Henry Hennel und Georges Simon Serullas hergestellt. Im Jahr 1828 stellte Michael Faraday Ethanol durch säurekatalysierte Hydratisierung von Ethylen her, einen Prozess, welcher der industriellen Ethanolsynthese ähnelt.
Heute wird Ethanol hauptsächlich durch Gärung aus Biomasse gewonnen. Im Kontext der Erzeugung von Biokraftstoff wird es Bioethanol genannt. Agraralkohol ist Ethanol aus Agrarrohstoffen, in Deutschland wird Agraralkohol unter staatlicher Aufsicht in landwirtschaftlichen Brennereien erzeugt.
Vorkommen
Ethanol ist ein in reifen Früchten und Säften natürlich vorkommendes Produkt der alkoholischen Gärung. Daneben kommt Ethanol natürlich aber auch in allen anderen Pflanzenteilen vor, wie den Wurzeln, Rhizomen und Knollen von Arznei-Engelwurz (Angelica archangelica), Möhren (Daucus carota), Rheum palmatum und Zwiebeln (Allium cepa), den Blüten von Telosma cordata, den Sämlingen von Bohnenkräutern (Satureja cuneifolia), Ginseng (Panax ginseng) und Meerträubel (Ephedra sinica) und den Harzen und Pflanzensäften der Amberbäume (Liquidambar styraciflua und Liquidambar orientalis) und Rosmarin (Rosmarinus officinalis).[35]
Viele Lebensmittel enthalten natürlicherweise geringe Mengen Ethanol. Auch alkoholfreies Bier enthält noch bis 0,5 Volumenprozent Ethanol.[36] Laut dem Deutschen Lebensmittelbuch dürfen Fruchtsäfte einen Ethanolgehalt von etwa 0,38 Volumenprozent aufweisen.[37] So enthält Apfelsaft bis 0,016, Traubensaft bis 0,059 Volumenprozent Ethanol.[38] Eine reife Banane kann bis zu 1 Volumenprozent, Brot bis 0,3 Volumenprozent enthalten. Reifer Kefir kann bis 1 Volumenprozent Ethanol enthalten, Sauerkraut bis zu 0,5 Volumenprozent. Der physiologische Ethanolgehalt des menschlichen Bluts beträgt etwa 0,02 bis 0,03 ‰.[39]
Ethanol wurde neben anderen organischen Molekülen wie Acetaldehyd in interstellaren Molekülwolken nachgewiesen, wobei deren Bildungsmechanismus ungeklärt ist.[40]
Herstellung
Alkoholische Gärung
Ethanol wird durch Gärung aus Biomasse, meist aus zucker- oder stärkehaltigen Feldfrüchten oder traditionell aus Produkten des Gartenbaus gewonnen. Dieser Prozess wird mit einer Reihe von Nahrungsmitteln kontrolliert durchgeführt, wodurch zum Beispiel Wein aus Weintrauben oder Bier aus Malz und Hopfen entstehen. Holzzucker kann als Nebenprodukt des Sulfitverfahrens zu Sulfitsprit fermentiert werden. Dieser kann aufgrund zahlreicher Verunreinigungen jedoch nur energetisch genutzt werden.
Vor der eigentlichen Gärung wird meist zuerst Stärke in Disaccharide gespalten, deren glycosidische Bindung durch Hydrolasen gelöst wird; anschließend werden die entstehenden Monosaccharide durch Hefe oder Bakterien vergoren. Bei einer Ethanolkonzentration nahe 15 % beginnen Hefezellen und Bakterien abzusterben, weshalb durch Gärung keine höhere Konzentration erreicht werden kann. Die Bruttogleichung der alkoholischen Gärung ist:
Destillation
Ethanol kann durch Destillation für technische und Genusszwecke konzentriert werden, da es bereits bei 78 °C verdampft.
Trinkalkohol
Zum Verzehr geeigneter Trinkalkohol wird durch Destillation – das sogenannte Brennen – einer alkoholhaltigen Maische aus landwirtschaftlichen Ausgangsprodukten gewonnen. Je nach Brennverfahren sind im Destillat, dem sogenannten Brand, neben Ethanol noch Aromen, Fuselöle, weitere organische Verbindungen und Wasser enthalten, die den Charakter und den Geschmack des Endproduktes wie zum Beispiel Weinbrand, Whisky oder Rum bestimmen. Für die Herstellung von Wodka wird hingegen fast reines Ethanol verwendet und nur noch mit Wasser verdünnt. Unverdünnt dient reines Ethanol mit der Verkehrsbezeichnung Ethylalkohol landwirtschaftlichen Ursprungs als Ausgangsprodukt für weitere alkoholische Getränke, zum Beispiel für die meisten Liköre. Alkoholische Getränke, die destilliertes Ethanol enthalten, heißen Spirituosen (umgangssprachlich auch Branntwein oder Schnaps) – im Gegensatz zu Wein und Bier, deren Ethanol ausschließlich durch alkoholische Gärung entstanden ist.
Technische Zwecke
Großtechnisch erfolgt die Herstellung reinen Ethanols für technische Anwendungen durch azeotrope Rektifikation (Schleppmittelrektifikation). Die Anlage besteht aus zwei Rektifikationskolonnen. In der Haupttrennsäule erfolgt die Rektifikation des Ethanol-Wasser-Gemisches bis in die Nähe des azeotropen Punktes. Das Sumpfprodukt ist Wasser.[41]
Dem Kopfprodukt, das aus 95,6 % Ethanol und 4,4 % Wasser besteht, wird der Hilfsstoff Cyclohexan beigemischt. Früher übliche Schleppmittel wie Benzol im Young-Verfahren oder wie Trichlorethen im Drawinol-Verfahren werden heutzutage nicht mehr verwendet.[42] Dieses Dreistoffgemisch aus Ethanol, Wasser und Schleppmittel gelangt in die Hilfsstoff-Trennsäule. Dort erfolgt eine Auftrennung in den im Sumpf anfallenden reinen Alkohol sowie in ein Cyclohexan-Wasser-Gemisch als Kopfprodukt. Cyclohexan und Wasser sind im flüssigen Zustand nicht mischbar und trennen sich nach der Kondensation in einem Abscheider (Dekanter). Der Hilfsstoff Cyclohexan wird am Einlauf der Hilfsstoff-Trennsäule wieder dem zuströmenden, azeotropen Ethanol-Wasser-Gemisch beigefügt. Er läuft im Kreislauf im oberen Bereich der Hilfsstoff-Trennsäule und wird deshalb als „kopflaufender Hilfsstoff“ bezeichnet. Wasserfreies Ethanol wird im Labormaßstab durch Destillation über wasserentziehenden Chemikalien wie Calciumoxid, wasserfreiem Calciumsulfat oder Molsieben gewonnen.[41] Der Prozess der Herstellung von absolutem Alkohol wird als Absolutierung bezeichnet.
Technische Synthesen
Ethanol wird durch chemische Synthese aus Wasser und Ethen im sogenannten indirekten Prozess homogenkatalytisch unter Zugabe von Schwefelsäure hergestellt. Auf diese Weise hergestellter Alkohol wird auch als Industriealkohol bezeichnet.
Der Prozess läuft zweistufig ab unter Bildung von Schwefelsäureestern, die in einem zweiten Schritt hydrolysiert werden müssen. Die Schwefelsäure muss nach erfolgter Hydrolyse wieder aufkonzentriert werden.[43] Im direkten Prozess dient auf Silika aufgebrachte Phosphorsäure als heterogener Katalysator. Bei Temperaturen bis zu 300 °C und Drücken von 70 bar wird Ethanol direkt aus Ethen und Wasser in der Gasphase hergestellt. Der Umsatz beträgt pro Reaktordurchgang allerdings nur 5 % bezogen auf Ethen.[43] Wegen der Abwasserproblematik und Korrosionsproblemen durch die anfallende Schwefelsäure beim indirekten Prozess wird Ethanol industriell heutzutage mittels Phosphorsäurekatalyse hergestellt. Die Bruttogleichung für beide Prozesse lautet:
Prinzipiell ist die Gewinnung von Ethanol durch katalytische Hydrierung von Acetaldehyd möglich. Bei hohen Wasserstoffdrücken wird Acetaldehyd dabei an nickelhaltigen Kontakten umgesetzt:[44]
Ethanol fällt im Synol-Verfahren durch Reaktion von Kohlenstoffmonoxid mit Wasserstoff an und kann destillativ von den anderen entstehenden Alkoholen getrennt werden. Durch Kernspinresonanzspektroskopie lässt sich anhand der Wasserstoff- und Kohlenstoffisotopenverhältnisse synthetisches Ethanol aus fossilen Rohstoffen von Ethanol aus nachwachsenden Rohstoffen unterscheiden. Dieser Umstand lässt sich zum Nachweis des Panschens von Wein oder Spirituosen mit industriellem Ethanol nutzen.[45] Bei durch Gärprozesse hergestelltem Ethanol lässt sich über die Deuteriumverteilung die pflanzliche Herkunft feststellen.[46]
Produktionsmengen
Weltweit erzeugten die USA und Brasilien 2005 zusammen über 90 % der Jahresproduktion von 29 Millionen Tonnen.[47] Die größten europäischen Erzeuger sind Russland und Frankreich. Deutschland erzeugt jährlich fast 4 Mio. hl zu gleichen Teilen als Getränkealkohol und als Alkohol für chemisch-technische Zwecke, was einer Eigenbedarfsdeckung von etwa 62 % entspricht.
Neben der Produktion von Neutralalkohol für Getränke, Lebensmittel und technische Zwecke entfallen weltweit etwa 65 % auf die Herstellung von Kraftstoffethanol.[48] In den USA wird der Aufbau neuer Produktionsanlagen für Ethanol besonders forciert, vor allem durch das Gesetz „Energy Policy Act“ (EPACT) von 2005, das den Ausbau von erneuerbaren flüssigen Energieträgern fördern soll.
Besteuerung und Vergällung
Ethanol unterliegt in Deutschland, der Schweiz und vielen anderen Ländern der Welt, der Alkoholbesteuerung (bis 2018 Branntweinsteuer). Sie wird von der Zollverwaltung beim Inverkehrbringer (Spirituosenhersteller, berechtigter Empfänger, Branntweinlagerinhaber) zum Zeitpunkt des Lagerabganges erhoben. Ein Versand unter Steueraussetzung ist per BVD oder EVD möglich – beispielsweise zwischen Hersteller und Großhändler mit offenem Branntweinlager sowie bei Exportgeschäften.
Für technische Zwecke, etwa in Druckereien, bei der Lackherstellung, Reinigungsmittelproduktion, für Kosmetik und ähnliche Einsatzgebiete und als Brennspiritus ist die Verwendung von Ethanol steuerfrei möglich. Um zu verhindern, dass dieses Ethanol ohne Entrichtung der Steuer als Genussmittel getrunken oder solchen beigefügt wird, wird unversteuerter Alkohol unter Zollaufsicht vergällt. Vergällung bedeutet, dass Ethanol mit anderen Chemikalien, wie beispielsweise Methylethylketon (MEK) und zwei weiteren branntweinsteuerrechtlich vorgeschriebenen Markierungskomponenten, Petrolether, Cyclohexan, Diethylphthalat, Bitrex oder Ähnlichem versetzt wird, um es für den menschlichen Genuss unbrauchbar zu machen. Dies wird in Deutschland über die Branntweinsteuerverordnung (BrStV)[49] und in Österreich über die Verordnung des Bundesministers für Finanzen über die Vergällung von Alkohol (VO-Vergällung) geregelt.[50]
Bioethanol für die Beimischung zu Kraftstoff wird bei der Produktion mit ETBE oder Benzin vergällt. Die oben genannten, für Spiritus oder kosmetische Zwecke gängigen Vergällungsmittel, beispielsweise Methylethylketon (MEK), dürfen in Kraftstoffen nach EN 228 nicht verwendet werden.
Bei dem in Form von Brennspiritus als Brennstoff verwendeten Ethanol, beispielsweise für Rechauds sowie Camping- und Expeditionskocher, wird dem Ethanol zusätzlich zum MEK noch das extrem bittere Denatoniumbenzoat (1 Gramm/100 Liter) beigemischt. Das früher als Vergällungsmittel für Brennspiritus verwendete Pyridin wird wegen seiner gesundheitlichen Bedenklichkeit seit 1993 von deutschen Herstellern nicht mehr eingesetzt und ist seit dem 1. Juli 2013 nicht mehr zulässig.[51] Im Gegensatz zu Pyridin, dessen Siedepunkt bei 115 °C liegt, ist Denatoniumbenzoat ein Feststoff, der erst bei 163 bis 170 °C schmilzt. Es verdampft daher bei der Verwendung von Brennspiritus nicht, sondern reichert sich in den Dochten von Spiritusgeräten an, was zum Beispiel bei Spiritusglühlichtern und Spiritus-Vergaserkochern zu Betriebsstörungen führt.
Die Vergällungsmittel haben meist ähnliche Siedepunkte wie Ethanol, sodass sie sich durch Destillieren nur schwer entfernen lassen.
Als Gefahrgut hat Ethanol die „UN 1170“.
Eigenschaften
Physikalische Eigenschaften
| Flammpunkt | 12 °C (Angabe bezieht sich auf
Messung im geschlossenen Tiegel.)[4] |
| Zündtemperatur | 400 °C[4] |
| Explosionsgrenzen | untere: 3,1 Volumenprozent obere: 27,7 Volumenprozent max. Druck: 8,4 bar[4] |
| Schallgeschwindigkeit | 1180 m·s−1 (20 °C) Temp.-Abhängigkeit: −3,6 m·s−1·°C−1 |
| Dichte | 0,79 g·cm−3 = 0,79 kg·dm−3 |
| Energiedichte (Heizwert) | 7,44 kWh·kg−1 = 26,78 MJ·kg−1 5,87 kWh·l−1 = 21,14 MJ·l−1[52] |
| dynamische Viskosität | 1,2 · 10−3 Pa·s (20 °C) |
| kinematische Viskosität | 1,52 · 10−6 m²·s−1 (20 °C) |
| Oberflächenspannung | 0,02255 N·m−1 (20 °C) |
| Brechungsindex | 1,3638[2] |
| Biologische Abbaubarkeit | 94 % (OECD 301 E) |
| UN-Nummer | 1170 |
| Gefahrennummer | 30 + 33 |
| Tripelpunkt | 150 ± 20 K / 0,43 mPa[53] −123,15 ± 20 °C / 0,43 mPa |
| Kritischer Punkt | 514,0 K / 6,137 MPa / 168 cm³/mol[53][54] 240,85 °C / 6,137 MPa / 168 cm³/mol |
Herausragendes Merkmal des Ethanols ist seine Hydroxygruppe. Da ein Sauerstoffatom Elektronen stärker anzieht als Wasserstoff und Kohlenstoff, resultiert eine asymmetrische Verteilung der Elektronendichte entlang dieser Bindung: Es bildet sich ein molekularer Dipol. Er verleiht Ethanol seine typischen Eigenschaften. Zum einen ziehen sich die Dipole auf molekularer Ebene gegenseitig an, sodass daraus eine vergleichsweise hohe Siedetemperatur von 78 °C resultiert (Sp, Ethan = −88,6 °C), zum anderen ist Ethanol mit Flüssigkeiten mischbar, die ähnliche Dipoleigenschaften aufweisen, zum Beispiel mit Wasser und Methanol. Diese Eigenschaft wird als Hydrophilie bezeichnet. Gleichzeitig besitzt das Molekül einen organischen Rest, der ihm eine begrenzte Mischbarkeit mit rein lipophilen Substanzen verleiht. Aus diesem Grund ist Ethanol in der Chemie und Pharmazie ein wichtiges Lösungsmittel. Pflanzenauszüge oder andere Medikamente werden als alkoholische Lösungen, sogenannte „Tinkturen“, angeboten.
Ethanol bildet am Gefrierpunkt ausreichend große Einkristalle für die Bestimmung mittels Kristallstrukturanalyse. Es kristallisiert im monoklinen Kristallsystem mit der Raumgruppe Pc (Raumgruppen-Nr. 7) und weist bei 87 K die Gitterparameter a = 537,7 pm, b = 688,2 pm, c = 825,5 pm und β = 102,2° auf sowie 4 Formeleinheiten pro Elementarzelle.[55] Die Moleküle bilden über Wasserstoffbrückenbindungen mit einem Sauerstoff-Sauerstoff-Abstand von 271,6 pm und 273,0 pm lange Ketten. Die Konformation um die Kohlenstoff-Kohlenstoff-Bindung ist in beiden Molekülen versetzt. Während die Hydroxygruppe in einem Molekül entlang der C-C-OH-Achse eine gauche-Konformation besitzt, weist das andere Molekül eine trans-Konformation auf.[55]
Mischungen mit anderen Lösemitteln
Ethanol ist in jedem Verhältnis mit Wasser mischbar. Dabei kommt es beim Vermischen unter Wärmeentwicklung zu einer Volumenkontraktion. Das Gesamtvolumen einer Wasser/Ethanol-Mischung ist kleiner als die Summe der Einzelvolumina. So entstehen durch Mischen von 50 ml Ethanol mit 50 ml Wasser 97 ml Ethanol-Wasser-Gemisch (vgl. Rechnung sowie weitere Beispiele und Fazit im Hauptartikel Alkoholgehalt).
Der Schmelzpunkt wässriger Ethanollösungen sinkt mit steigendem Ethanolgehalt, bis bei einem Gehalt von 93,5 Massenprozent ein Eutektikum mit einer Schmelztemperatur von −118 °C erreicht wird.[56] Bei Temperaturen um −20 °C verdunstet Ethanol (96 %) kaum noch und nimmt eher zähflüssige Eigenschaften an. Bei −70 °C wird es noch zähflüssiger (Kühlol).
Ethanol bildet mit Wasser ein azeotropes Gemisch, welches aus 95,57 Gew.-% Ethanol und 4,43 Gew.-% Wasser besteht[57] und bei 78,2 °C siedet.[2]
In organischen Lösungsmitteln wie Tetrachlormethan bildet Ethanol in Abhängigkeit von der Konzentration über Wasserstoffbrückenbildung Dimere, Trimere und Tetramere. Die Bildungsenthalpie ist über Infrarotspektroskopieuntersuchungen ermittelbar. Sie liegt für das Tetramer bei 92 kJ mol−1, bei 42 kJ mol−1 für das Trimer und bei 21 kJ mol−1 für das Dimer.[58][59]
-
Exzessvolumen (Volumenkontraktion) bei der Mischung von Ethanol und Wasser
-
Fest-Flüssig-Phasendiagramm von Ethanol-Wasser-Gemischen
Chemische Eigenschaften
Die OH-Gruppe des Ethanols ist mit einem pKs-Wert von 16[5] sehr schwach sauer, wodurch sie in der Lage ist, mit starken Basen (wie etwa den Alkalimetallen Natrium und Kalium) ein Proton (H+) abzuspalten. Durch Umsetzen mit Alkalimetallen wird Ethanol quantitativ in seine deprotonierte Form, das Ethanolat-Ion (CH3CH2O−), überführt. Die Reaktion läuft unter Entwicklung von Wasserstoff ab:
Ethanol löst sich in allen Verhältnissen mit Wasser und vielen anderen organischen Lösungsmitteln wie Diethylether, Chloroform und Benzol.
Autoprotolyse
Ethanol kann sowohl als Brønsted-Säure als auch als Brønsted-Base reagieren und ist damit ein Ampholyt:
Die Autoprotolysekonstante ist dabei pKau = 19,5.
Nukleophile Substitution
In aprotischen Lösungsmitteln reagiert Ethanol mit Halogenwasserstoffen über eine nukleophile Substitution zu Ethylhalogeniden. Ethanol und Chlorwasserstoff reagieren zu Ethylchlorid und Wasser:
Ethanol und Bromwasserstoff reagieren zu Ethylbromid und Wasser:
Ethylhalogenide können spezifischer durch Halogenierungsreagenzien wie Thionylchlorid oder Phosphortribromid gebildet werden.
Veresterung
Ethanol reagiert säurekatalysiert mit Carbonsäuren in einer Gleichgewichtsreaktion zu Ethylestern:
Da das gebildete Wasser jedoch höher siedet als Ethanol, wird Ethylester besser durch Reaktion mit Säureanhydriden hergestellt. Ethylester finden Verwendung als Zusätze für Kosmetika sowie Geruchs- und Geschmacksstoffe.
Dehydratation
Sehr starke Säuren, wie Schwefelsäure, katalysieren die Dehydratation des Ethanols. Es bilden sich Diethylether oder Ethen:
Ethanol spaltet in einer Eliminierungsreaktion Wasser unter Bildung einer Doppelbindung ab:
Welches Produkt sich bildet, hängt von den Reaktionsbedingungen wie Temperatur, Konzentrationen usw. ab. Bei der Dehydratation kann unter bestimmten Reaktionsbedingungen das hochgiftige Diethylsulfat gebildet werden.[60]
Oxidation
Ethanol kann bereits von Luftsauerstoff bei Raumtemperatur über Acetaldehyd bis hin zur Essigsäure oxidiert werden. Derartige Reaktionen werden beispielsweise in biologischen Systemen von Enzymen katalysiert. Im Labor dienen kräftige anorganische Oxidationsmittel wie Chromsäure oder Kaliumpermanganat zur Oxidation zu Essigsäure. Die teilweise Oxidation bis zum Acetaldehyd gelingt mit schwächeren Oxidationsmitteln, etwa mit Pyridiniumchlorochromat (PCC).
Die Oxidation des Ethanols muss nicht auf der Stufe der Essigsäure stehenbleiben. An Luft verbrennt Ethanol mit blauer Flamme (siehe Bild) mit einem Heizwert von 26,8 MJ/kg zu Kohlendioxid und Wasser:
Mit Chlor oder Brom reagiert Ethanol langsam zu Acetaldehyd und anderen halogenhaltigen Oxidationsprodukten. Acetaldehyd bildet mit überschüssigem Ethanol Halbacetale. Es überwiegt aber die Halogen-Addition an die Enolform des Acetaldehyds und es bildet sich dadurch (tränenreizendes) α-Halogenacetaldehyd. Die weitere Oxidation mit Chlor führt letztlich zu Halbacetalen des Chlorals.
Desinfektion aufgrund Denaturierung
Entsprechend der Denaturierung durch Säuren oder Laugen kann Ethanol die in Biopolymeren zur Aufrechterhaltung der Struktur erforderlichen Wasserstoffbrücken stören, indem es als polares Lösungsmittel interferiert.[61] Daraus resultieren Konformationsänderungen. 50- bis 70-prozentiges Ethanol denaturiert die meisten Proteine und Nukleinsäuren. Da durch Zerstörung der Raumstruktur Membranproteine ihre Funktion einbüßen und aufgrund der Membrandefekte die betreffenden Zellen luftballonartig platzen, kann mit höherprozentigem Ethanol desinfiziert werden: Bakterien- und Pilzzellen werden über die Denaturierung ihrer Membranproteine irreversibel inaktiviert, entsprechend werden behüllte Viren ihrer proteinhaltigen Hülle beraubt.[62]
Verwendung
Ethanol findet Verwendung in den drei Hauptmärkten:
- alkoholische Getränke
- Rohstoff für die chemische Industrie
- Energieträger (Benzinzusatz)
Ethanol, das aus der Vergärung von zucker- und stärkehaltigen Lebensmitteln stammt, wird in allen Bereichen eingesetzt. Synthetisches Ethanol wird nur als Chemierohstoff und Energieträger verwendet. Die konkurrierende Verwendung von Ethanol aus der Nahrungsmittelproduktion als Chemie- und Energierohstoff wird kontrovers diskutiert.
Die Hauptmenge des produzierten Ethanols wird in Form von alkoholischen Getränken für Genusszwecke verbraucht.[2] Es dient weiterhin als Lösungsmittel sowohl für Konsumprodukte unter anderem im Haushalt (Parfüm, Deodorant) als auch für medizinische Anwendungen (Lösungsmittel für Medikamente, Desinfektionsmittel) sowie in der Industrie selbst ebenfalls als Lösungsmittel und allgemein als Brennstoff.
Haushalts- und Konsumprodukte
Ethanol findet als hervorragendes Lösungsmittel überall im Haushalt Verwendung, so als Träger für Geruchsstoffe wie Parfüm, Deodorant und Duftspray. Auch als Reinigungsmittel beispielsweise für Glas (Fensterreinigungsmittel), Chrom, Kunststoff, in Kfz-Scheibenwaschlösungen und als Fleckenentferner findet Ethanol Verwendung. Als Zusatz zum Wasser dient es als Frostschutzmittel.
Ethanol findet verbreiteten Einsatz als Lebensmittelzusatz. So wird Portweinen, Sherry und anderen Südweinen Ethanol zugegeben, die sogenannte Aufspritung, um zum gewünschten Zeitpunkt den Fermentationsprozess zu beenden.[63] Durch die vorzeitig beendete Gärung haben diese Liköre und Weine – bis auf einige Ausnahmen – einen hohen Restzuckergehalt und sind dadurch sehr süß.[64]
Ethanol kann zur Haltbarmachung anderer Lebensmittel zugesetzt werden.[65]
Als Brennstoff für Campingkocher als sogenannter Brennspiritus findet Ethanol im Haushalt eine energetische Verwendung. Durch Zugabe von Celluloseacetat oder Seife kann Brennspiritus in ein Gel, den sogenannten Hartspiritus überführt werden.[66]
Einfache Kapillarthermometer mit blau oder rot sichtbarer Flüssigkeitssäule sind mit gefärbtem Ethanol gefüllt. Bei ausreichend langem, graduiertem Rohr können Temperaturen vom Schmelzpunkt bis nahe dem Siedepunkt gemessen werden, womit Außentemperaturen gut abgedeckt werden.
Medizin und Pharmazie
Die Wirksamkeit als Desinfektionsmittel oder Antiseptikum (etwa zur Händedesinfektion) hängt von der Konzentration des Ethanol-Wasser-Gemisches ab. Bei einem optimalen Alkoholgehalt zwischen 50 und 80 %[67] wird die Bakterienhülle zerstört und Ethanol wirkt damit tödlich. Alle Bakterien einschließlich der Tuberkelbakterien werden innerhalb einer Minute durch Denaturierung der Bakterienzellwand abgetötet (Bakterizidie). Daneben wirken Ethanol-Wasser-Mischungen durch ihren hohen osmotischen Druck; 70-prozentiges Ethanol hat mit 250·106 Pascal den höchsten osmotischen Druck aller Mischungen mit Wasser.[3] Eingeschränkt wirksam ist das Gemisch gegen Viren, nicht wirksam gegen Bakterien-Endosporen. Bei offenen Wunden sollte es nicht eingesetzt werden: Neben einem unangenehmen Brennen wirkt Ethanol (vorwiegend kutan) vasodilatierend, was im Allgemeinen zwar förderlich für die Reinigung von Wunden ist, aber besonders bei größeren Verletzungen Blutungen drastisch verschlimmern kann. Lösungen mit über 80 % Alkoholgehalt zeigen eine noch stärkere Wirkung, werden aber aufgrund mangelnder Hautverträglichkeit nicht regelmäßig eingesetzt. Wasserfreies Ethanol härtet die Bakterienhülle, die Bakterien bleiben dadurch am Leben.[68] Das Trinken von Ethanol oder alkoholischen Getränken wirkt nicht antiseptisch. Getränke mit einem Ethanolgehalt von weniger als 20 % töten praktisch keine Keime ab. Durch Kombination mit Alkalien (etwa 1 %) oder Peroxycarbonsäuren (0,2 bis 0,5 %) wird die Wirksamkeit unter anderem gegen Viren und Sporen stark verbessert.[67] Ethanol dient als Lösungsmittel zur Herstellung der Iodtinktur, einer Mischung aus Iod in Ethanol zur Wunddesinfektion, der zu Vermeidung der Bildung von Iodwasserstoff Kaliumiodid zugegeben wird.
95-prozentiges beziehungsweise reines Ethanol kann als PEI-Therapie zur Verödung „heißer“ Schilddrüsenknoten[69] (Perkutane Ethanol-Injektionstherapie)[70] und anderer umschriebener Tumoren wie des Leberzellkarzinoms (ebenfalls Perkutane Ethanol-Injektionstherapie)[71] benutzt werden.
Flüssige Medikamente können Ethanol als Lösungsmittel, Cosolvens oder Lösungsvermittler enthalten, wenn der oder die Arzneistoffe in Wasser schlecht löslich oder unlöslich sind. Ethanol selbst ist mit Wasser beliebig mischbar. Es hat eine wichtige Funktion in der Konservierung und Stabilisierung flüssiger pflanzlicher Medikamente (Phytotherapeutika). Die Medikamente sind entsprechend der Arzneimittel-Warnhinweisverordnung (AMWarnV) zu kennzeichnen.
Durch Einreiben der Haut mit hochprozentiger Ethanollösung (beispielsweise Franzbranntwein) wird die Durchblutung gefördert. Zur Wundreinigung wurde „gebrannter Wein“ von deutschsprachigen Wundärzten seit dem 12. Jahrhundert regelmäßig verwendet.[72][73] Volksmedizinisch werden verdünnte ethanolische Lösungen heute noch zur Behandlung von Insektenstichen verwendet. Ein alkoholgetränktes Tuch wird dazu einige Zeit auf den frischen Stich gelegt. Die Schmerzlinderung geschieht aufgrund der kühlenden Wirkung der Ethanollösung; der Juckreiz wird unterdrückt. Eine chemische Veränderung oder Inaktivierung der Gifte bewirkt Ethanol jedoch nicht. Als schmerzstillende und Empfindungslosigkeit hervorrufende Narkosemittel wurden alkoholhaltige Tränke bereits im Altertum[74] verwendet.
Bei einer Vergiftung mit Methanol wird als erste Maßnahme Ethanol intravenös gegeben, was die Umwandlung von Methanol über das Enzym Alkoholdehydrogenase in das giftige Methanal hemmt. Ethanol bindet etwa 25-mal stärker an Alkoholdehydrogenase als Methanol.[75] Bei einer schweren Alkoholsucht kann ein Alkoholprädelir mit Ethanol unterbrochen werden, um eine akute Zweiterkrankung ohne die sonst auftretenden Symptome behandeln zu können.
Ethanol als Kraftstoff
Ethanol findet als Ethanol-Kraftstoff in Form des biogenen Bioethanols Verwendung als Kraftstoff für Ottomotoren, wobei vor allem Mischungen mit Benzin vorliegen. Dafür kann sowohl fossiles als auch aus regenerativer Biomasse hergestelltes Bioethanol verwendet werden, da es chemisch gesehen keinen Unterschied zwischen beiden Arten gibt. Aufgrund der Verfügbarkeit, der Herstellungskosten und politischer Fördermaßnahmen wird heute vor allem Bioethanol verwendet, das auf der Basis von fermentierbarem Zucker (Zuckerrohr und Zuckerrübe) und Stärke (vor allem Mais- und Weizenstärke) erzeugt wird. Es wird untersucht, ob zukünftig die Nutzung von Cellulose-Ethanol aus Holz möglich ist.
Ethanol wird vor allem als Beimischung zu herkömmlichem Kraftstoff genutzt, beispielsweise in einer Konzentration von 5 % Ethanol (E5 als Beimischung in gewöhnlichem Fahrzeugbenzin) oder 85 % Ethanol (als E85 für dafür geeignete Fahrzeuge). Im Zusammenhang mit dem Kyoto-Protokoll wird heute häufig über die Herstellung und den Einsatz biogener Treibstoffe (Biokraftstoffe) und die Reduzierung von Kohlenstoffdioxid-Emissionen pro gefahrenem Kilometer debattiert. In der Europäischen Union stieg die Produktionsmenge von Ethanol für den Kraftstoffsektor von 525 Millionen Liter im Jahr 2004 auf 3,7 Milliarden Liter im Jahr 2009. Seit 2011 bleibt die Ethanolproduktion sowohl für die Verwendung als Kraftstoff wie auch für andere Zwecke gleich.[76]
Ethanol wurde nach einer Entwicklung von Wernher von Braun zudem bis in die 1950er Jahre als Treibstoff für die Raketen der Typen A1, A2, A3, A4, A4b und A5 verwendet. Im Unterschied zu Benzin kann durch Verdünnen mit Wasser für Testzwecke leicht der Heizwert heruntergesetzt werden, um bei Probeläufen von Triebwerken Explosionen zu verhindern, zum anderen war Ethanol während des Zweiten Weltkriegs leicht aus landwirtschaftlichen Produkten gewinnbar, im Gegensatz zum knappen Benzin.
Neben reinem Ethanol finden seine Derivate Einsatz im Kraftstoffbereich. So wird Ethyl-tert-butylether (ETBE) analog zum Methyl-tert-butylether zur Erhöhung der Oktanzahl von Ottokraftstoffen eingesetzt. ETBE wird durch säurekatalysierte Addition von Ethanol an Isobuten hergestellt:
Weitere Nutzung von Ethanol
Ethanol ist ein wichtiges Lösungsmittel und Zwischenprodukt in der chemischen Industrie. Ein wichtiges Folgeprodukt ist Ethylchlorid, das aus Ethanol durch Umsetzung mit Chlorwasserstoff hergestellt wird.[43] Die Oxidation liefert weitere Folgeprodukte wie Acetaldehyd und Essigsäure.[43]
Ethanol wird in einer Vielzahl von Veresterungsreaktionen eingesetzt. Die erhaltenen Ester haben vielfältige Verwendungsmöglichkeiten als Lösungsmittel und als Zwischenprodukt für Folgesynthesen. Ein wichtiges Folgeprodukt ist Ethylacrylat, ein Monomer, das als Co-Monomer in verschiedenen Polymerisationsprozessen eingesetzt wird. Essigsäureethylester wird als Lösungsmittel für Klebstoffe und Nagellack und zur Extraktion von Antibiotika eingesetzt. Glycolether wie 2-Ethoxyethanol sind als Lösungsmittel für Öle, Harze, Fette, Wachse, Nitrozellulose und Lacke weit verbreitet.
In Umkehrung der petrochemischen Herstellungsreaktion entsteht aus Ethanol wieder Ethen, das zum Beispiel vom brasilianischen Chemieunternehmen Braskem als Rohstoff für die Polyethylenherstellung genutzt wird. In einer Anlage in Rio Grande, Brasilien, produziert Braskem bereits auf Zuckerrohr basierendes Polyethylen in einer Anlage mit einem Ausstoß von 200.000 t pro Jahr.[77]
Flüssigkeitspräparate aus Biologie und Humanmedizin werden vielfach mit Ethanol-Wasser-Mischungen oder Formalin fixiert und konserviert.[78]
Biologische Bedeutung
Ethanol wird im gesamten Verdauungstrakt aufgenommen. Dies beginnt in geringem Umfang bereits in der Mundschleimhaut. Das dort resorbierte Ethanol geht direkt in das Blut über und wird damit über den gesamten Körper einschließlich des Gehirns verteilt. Etwa 20 % werden im Magen resorbiert, der Rest im Dünndarm.[79] Das in Magen und Darm aufgenommene Ethanol gelangt zunächst mit dem Blut in die Leber, wo es teilweise abgebaut wird. Die Ethanolaufnahme wird durch Faktoren, welche die Durchblutung steigern, erhöht, beispielsweise Wärme (Irish Coffee, Grog), Zucker (Likör) und Kohlenstoffdioxid (Sekt). Dagegen verlangsamt Fett die Aufnahme. Dies führt nicht zu einer niedrigeren Resorption des Alkohols insgesamt, sondern nur zu einer zeitlichen Streckung.[80]
Etwa 2 bis 10 % des aufgenommenen Ethanols werden unverändert über Urin, Schweiß und Atemluft wieder abgegeben.[81] Ein Teilabbau findet schon im Magen statt; eine dort gefundene sigma-Alkoholdehydrogenase zeigt eine etwa um den Faktor 200 höhere Aktivität als die in der Leber lokalisierten Isoenzyme. Der Anteil am gesamten Ethanolabbau beträgt lediglich ungefähr 5 %.[82]
In der Leber wird der Hauptteil des Ethanols – wie andere wasserlösliche Gifte – durch die Enzyme Alkoholdehydrogenase (ADH) und Katalase sowie das MEOS-System zu Ethanal (Acetaldehyd, H3C-CHO) abgebaut, um weiter durch Acetaldehyddehydrogenase zu Essigsäure oxidiert zu werden. Die Essigsäure wird über den Citratzyklus und die Atmungskette in allen Zellen des Körpers unter Energiegewinnung zu CO2 veratmet. Die Leber kann bei erheblich gesteigertem, regelmäßigem Konsum ihre Abbauaktivität in geringem Maße anpassen. Das Zwischenprodukt Ethanal ist für die sogenannten „Kater“-Symptome wie Kopfschmerzen, Übelkeit und Erbrechen mitverantwortlich.[83] Der Abbau des Ethanals wird durch Zucker gehemmt, daher ist der Kater bei süßen alkoholischen Getränken, insbesondere Likör, Bowlen, Fruchtweinen und manchen Sektsorten besonders intensiv.
Die Abbaurate durch die Alkoholdehydrogenase ist innerhalb gewisser Grenzen konstant. Sie beträgt bei Männern etwa 0,1 und bei Frauen 0,085 Gramm pro Stunde und Kilogramm Körpergewicht.[84][85] Die exakt gemessenen Abbauraten für Männer lagen dabei zwischen 0,088 und 0,146 Gramm pro Stunde und Kilogramm Körpergewicht.[82] Bei Männern findet sich eine leicht erhöhte Aktivität der gastrischen Alkoholdehydrogenase im Magen, mit der Folge einer geringfügigen Beschleunigung des Alkoholabbaus. Hochdosierte Aufnahme von Fructose kann bei manchen Menschen durch Unterstützung des Katalase-Ethanolabbaus zu einer schnelleren Metabolisierung führen.[83] Bei höherer Alkoholkonzentration – ab etwa 50 g Ethanolaufnahme pro Tag[82] – oder bei chronischen Trinkern wird der Alkohol zusätzlich über das mikrosomale Ethanol oxidierende System (MEOS) abgebaut. Dabei wird Ethanol im glatten ER der Leberzellen durch Cytochrom P450 (CYP2E1) unter Sauerstoffverbrauch ebenfalls zu Ethanal oxidiert. Ethanol bewirkt situativ eine Betäubung, eine Stimulation oder einen Stimmungswandel. Es führt zu einer Erweiterung insbesondere der peripheren Blutgefäße.
Toxikologie
Ethanol wird von Pathologen zu den obligat hepatotoxischen Stoffen gezählt,[89] also zu den Lebergiften. Als gesichert gilt auch ein direkter toxischer Effekt des Alkohols auf die Erythropoiese, die Bildung roter Blutzellen.[90] In der Pädiatrie ist Ethanol als teratogene Noxe bekannt,[91] ein die Leibesfrucht schädigendes Gift. Pharmakologen und Toxikologen sprechen von „akuter Vergiftung“ ab einer bestimmten Schwellendosis sowie von einer „chronischen Vergiftung“ beim Alkoholismus.[92] Aufgrund der cytotoxischen und neurotoxischen Wirkung der Substanz gilt Alkoholkonsum allgemein als gesundheitsschädlich, umso mehr, je größer die konsumierte Menge ist.[93] Selbst ein bewusst vorsichtiger Konsum kann erhebliche Schädigungen bis hin zu Krebs, Leberzirrhose oder Gehirnschäden verursachen.[94] Ethanol in Getränken wird von der Internationalen Agentur für Krebsforschung als krebserzeugend eingestuft.[95][96] Regelmäßiger Alkoholkonsum kann abhängig machen (siehe Alkoholabhängigkeit). Laut einer Studie der Weltgesundheitsorganisation starben im Jahr 2012 mehr als 3,3 Millionen Menschen an den Folgen des Alkoholkonsums.[97] Die Aufnahme führt – ab etwa 0,5–1 Promille Ethanolkonzentration im Blut – zu typischen akuten Trunkenheitssymptomen wie Schwindel, Übelkeit, Orientierungsstörung, Redseligkeit und gesteigerter Aggressivität, bei höheren Dosen zu Schläfrigkeit und Teilnahmslosigkeit bis hin zum Koma. Die letale Dosis (LD) liegt etwa bei 3,0 bis 4,0 Promille für ungeübte Trinker. Es wurden jedoch schon Werte über 7 Promille gemessen.[98] Die LD50 beträgt für die Ratte 7060 mg/kg bei oraler Applikation.[8] Bei einer akuten Ethanolvergiftung kann der noch im Magen befindliche Alkohol durch Herbeiführen von Erbrechen oder durch Auspumpen des Mageninhalts teilweise entfernt werden. Alkoholpsychosen sind beschrieben worden.[99][100]
Nachweis
Ethanol kann durch Veresterung als p-Nitrobenzoesäureester oder 3,5-Dinitrobenzoesäureester nachgewiesen werden. Die Reaktion erfolgt durch Umsetzung mit dem entsprechenden Säurechlorid. Unspezifisch kann Ethanol durch die Iodoformprobe nachgewiesen werden. Durch chromatografische Methoden wie der Gaschromatografie kann Ethanol quantitativ bestimmt werden. Nasschemisch-quantitativ ist der Nachweis durch Oxidation mit einem Überschuss von Kaliumdichromat möglich, wobei das nicht umgesetzte Kaliumdichromat jodometrisch ermittelt werden kann.
In der Lebensmittelanalytik macht man sich den Dichteunterschied zwischen Wasser und Ethanol zunutze. Der Ethanolgehalt wird in einer (Wasserdampf-)Destillation abgetrennt und pyknometrisch bestimmt. Alternativ kann die Dichte auch im Biegeschwinger gemessen werden. Bei beiden Verfahren wird anhand von Tabellenwerten ausgewertet.
Im Protonenresonanzspektrum weist Ethanol bei Raumtemperatur eine Triplettstruktur durch Kopplung der Protonen der Hydroxygruppe mit den Methylenprotonen auf. Dies weist auf eine Fixierung der Hydroxygruppe gegenüber den Methylenprotonen hin. Mit steigenden Temperaturen wird die Aufspaltung kleiner und verschwindet durch die steigende Rotation der Hydroxygruppe schließlich ganz.[101]
Die Ethanolkonzentration während des Herstellungsprozesses, etwa in Brauereien, kann infrarotspektroskopisch durch die Messung der Intensität der Schwingungsfrequenz der C-H-Bande bei 2900 cm−1 überwacht werden. Das Infrarotspektrum für Ethanol weist eine C-H-, eine O-H- und eine C-O-Streckschwingung sowie verschiedene Biegeschwingungen auf. Die O-H-Streckschwingung erscheint als eine breite Bande bei etwa 3300–3500 cm−1, die C-H-Streckschwingung bei etwa 3000 cm−1.[102]
-
1H-NMR-Spektrum von Ethanol
-
Infrarotspektrum von flüssigem Ethanol
mit einer O-H-Bande bei 3300 cm−1
und einer C-H-Bande bei 2950 cm−1
Siehe auch
Literatur
- Allinger, Cava, de Jongh, Johnson, Lebel, Stevens: Organische Chemie. 1. Auflage, Walter de Gruyter, Berlin 1980, ISBN 3-11-004594-X, S. 125–127.
- Beyer, Walter: Lehrbuch der Organischen Chemie. 19. Auflage, S. Hirzel Verlag, Stuttgart 1981, ISBN 3-7776-0356-2, S. 115–117.
- Morrison, Boyd: Lehrbuch der Organischen Chemie. 3. Auflage, VCH, Weinheim 1986, ISBN 3-527-26067-6, S. 526–527.
- Beilstein: Handbuch der Organischen Chemie. 1. Band, S. 292–314 (ext. Link).
Weblinks
- Literatur von und über Ethanol im Katalog der Deutschen Nationalbibliothek
- Was ist eigentlich Ethanol? Espresso, 18. Mai 2020.
- Wie wirkt Alkohol im Gehirn? Quarks & Co, 10. Februar 2004.
- Peter Bützer: „Alkohol“ Ethanol. (PDF; 966 kB).
Einzelnachweise
- ↑ Eintrag zu ALCOHOL in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2019.
- ↑ a b c d e f g h i j Eintrag zu Ethanol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 22. März 2015.
- ↑ a b Gerhard Eisenbrand (Hrsg.), Peter Schreier (Hrsg.): RÖMPP Lexikon Lebensmittelchemie. 2. Auflage. Thieme Verlag, Stuttgart 2006, S. 322.
- ↑ a b c d e f g h i j Eintrag zu Ethanol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. Januar 2024. (JavaScript erforderlich)
- ↑ a b Eintrag zu Ethanol in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ Eintrag zu Ethanol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 64-17-5 bzw. Ethanol), abgerufen am 13. September 2019.
- ↑ a b G. Stuart Wiberg, H. Locksley Trenholm, Blake B. Coldwell: Increased ethanol toxicity in old rats: Changes in LD50, in vivo and in vitro metabolism, and liver alcohol dehydrogenase activity. In: Toxicology and Applied Pharmacology. Vol. 16, 1970, S. 718–727, doi:10.1016/0041-008X(70)90077-3.
- ↑ Gigiena i Sanitariya. For English translation, see HYSAAV, 1967, Vol. 32(3), S. 31.
- ↑ Raw Material Data Handbook. Vol. 1: Organic Solvents, 1974, S. 44.
- ↑ Matti Välimäki, Matti Härkönen, Reino Ylikahri: Acute Effects of Alcohol on Female Sex Hormones. In: Alcoholism: Clinical and Experimental Research. Vol. 7, 1983, S. 289–293, doi:10.1111/j.1530-0277.1983.tb05462.x.
- ↑ S. J. Baker, G. J. Chrzan, C. N. Park, J. H. Saunders: Behavioral effects of 0 and 0.05 % blood alcohol in male volunteers. In: Neurobehavioral Toxicology and Teratology. Vol. 8, 1986, S. 77–81, PMID 3703098.
- ↑ M. Yamagishi, T. Iwasaki: Acute alcohol intoxication in a two-month-old baby. In: Journal of UOEH. Vol. 9, 1987, S. 53–59, PMID 3576010.
- ↑ a b W. M. Haynes (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-18.
- ↑ Chemisch-fachsprachliche Ausdrücke, vgl. Eintrag Ethanol bzw. Ethylalkohol in duden-online; abgerufen am 13. Mai 2018.
- ↑ Äthanol. duden-online; abgerufen am 14. Mai 2018.
- ↑ Äthylalkohol. duden-online; abgerufen am 14. Mai 2018.
- ↑ [[Oskar Scheuer[O. F. Scheuer]]: Rauschgifte. In: Leo Schidrowitz (Hrsg.): Sittengeschichte des Lasters. Die Kulturepochen und ihre Leidenschaften (= Sittengeschichte der Kulturwelt und ihrer Entwicklung in Einzeldarstellungen. Band 5). Verlag für Kulturforschung, Wien/Leipzig 1927, S. 93–184, hier: S. 111–120.
- ↑ Robert Dudley: Ethanol, fruit ripening, and the historical origins of human alcoholism in primate frugivory. In: Integrative and Comparative Biology. Vol. 44, Nr. 4, 2004, S. 315–323, doi:10.1093/icb/44.4.315.
- ↑ J. Westermeyer: Cross-cultural studies on alcoholism. In: H. W. Goedde: Alcoholism: Biomedical and genetic aspects. Pergamon Press, New York 1989, S. 305–311.
- ↑ a b Diana von Cranach: Drogen im Alten Ägypten. In: G. Völger, K. Welck: Rausch und Realität: Drogen im Kulturvergleich. Bd. 2, Rowohlt, Reinbek 1982, ISBN 3-499-34006-2, S. 480–487.
- ↑ Helmut Hans Dittrich: Mikrobiologie des Weines. Ulmer Eugen Verlag, 2005, ISBN 3-8001-4470-0, S. 89.
- ↑ Claus Priesner, Karin Figala: Alchemie: Lexikon einer hermetischen Wissenschaft. C.H. Beck, München 1998, ISBN 3-406-44106-8, S. 146.
- ↑ Friedrich Kluge, Alfred Götze: Etymologisches Wörterbuch der deutschen Sprache. 20. Auflage. Hrsg. von Walther Mitzka. De Gruyter, Berlin / New York 1967; Neudruck („21. unveränderte Auflage“) ebenda 1975, ISBN 3-11-005709-3, S. 13 (Alkohol).
- ↑ Friedrich Dobler: Die chemische Fundierung der Heilkunde durch Theophrastus Paracelsus: Experimentelle Überprüfung seiner Antimonpräparate. In: Veröffentlichungen der Internationalen Gesellschaft für Geschichte der Pharmazie. Neue Folge, Band 10, 1957, S. 76–86, hier: S. 80.
- ↑ Lu Gwei-Djen, Joseph Needham, Dorothy Needham: The coming of ardent water. In: Ambix. Band 19, 1972, S. 69–112.
- ↑ Paul Diepgen, Heinz Goerke: Aschoff/Diepgen/Goerke: Kurze Übersichtstabelle zur Geschichte der Medizin. 7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 18.
- ↑ Edmund O. von Lippmann und Karl Sudhoff: Thaddäus Florentinus (Taddeo Alderotti) über den Weingeist. In: Sudhoffs Archiv. Band 7, 1914, S. 379–389.
- ↑ Gundolf Keil: Ipokras. Personalautoritative Legitimation in der mittelalterlichen Medizin. In: Herkunft und Ursprung. Historische und mythische Formen der Legitimation. Hrsg. von Peter Wunderli, Jan Thorbecke, Sigmaringen 1994, S. 157–177; hier: S. 170.
- ↑ Taddeo Alderotti: I „Consiglia“. Publicati a cura di Giuseppe Michele Nardi, Turin 1937, S. 235–242.
- ↑ Paul Braun: Das Weißenauer Alkoholrezept aus dem 13. Jahrhundert. In: Beiträge zur Württembergischen Apothekengeschichte V (1960–1962), Nr. 3, 1961, S. 78 f.
- ↑ Leo Jules van de Wiele: De eerste publikatie in het Nederlands over alkohol. In: Pharm. Tschr. Belg. Band 41, 1964, S. 65–80.
- ↑ Ram B. Gupta: Gasoline, Diesel and Ethanol Biofuels from Grasses and Plants. Cambridge Univ. Press, 2010, ISBN 0-521-76399-1, S. 74.
- ↑ Otto Zekert (Hrsg.): Dispensatorium pro pharmacopoeis Viennensibus in Austria 1570. Hrsg. vom österreichischen Apothekerverein und der Gesellschaft für Geschichte der Pharmazie. Deutscher Apotheker-Verlag Hans Hösel, Berlin 1938, S. 159 (Vinum sublimatum: Sublimierter Wein ist Weingeist, Alkohol).
- ↑ ETHANOL (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 11. September 2021.
- ↑ Etikettenschwindel – Alkoholfreies Bier enthält doch Alkohol. welt.de, 28. März 2012, abgerufen am 22. März 2015.
- ↑ Leitsätze für Fruchtsäfte. (PDF) Bundesministerium für Ernährung und Landwirtschaft, 27. November 2002, abgerufen am 23. Oktober 2021.
- ↑ Anhang I, Nr. 8 der Verordnung (EG) Nr. 1439/1999.
- ↑ Peter Bützer: „Alkohol“ Ethanol. (PDF; 1000 kB) Pädagogische Hochschule St.Gallen, Februar 2015, abgerufen am 22. März 2015.
- ↑ D. T. Halfen, A. J. Apponi, N. Woolf, R. Polt, and L. M. Ziurys: A Systematic Study of Glycolaldehyde in Sagittarius B2(N) at 2 and 3 mm: Criteria for Detecting Large Interstellar Molecules. In: The Astrophysical Journal. Vol. 639, Nr. 1, 2006, S. 237–245, doi:10.1086/499225.
- ↑ a b H. G. Hirschberg: Handbuch Verfahrenstechnik und Anlagenbau. Chemie, Technik und Betriebswirtschaft. Springer, Berlin 1999, ISBN 3-540-60623-8, S. 350–355.
- ↑ Beyer-Walter, Lehrbuch der Organischen Chemie, 23. Auflage, S. Hirzel Verlag 1998, ISBN 3-7776-0808-4
- ↑ a b c d W. Keim, A. Behr, G. Schmitt: Grundlagen der Industriellen Chemie. Salle-Sauerländer Verlag, 1986, ISBN 3-7935-5490-2, S. 183–184.
- ↑ Eberhard Breitmaier, Günther Jung: Organische Chemie. Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstruktur. Thieme, Stuttgart 2005, ISBN 3-13-541505-8, S. 214.
- ↑ C. Bauer-Christoph, N. Christoph, M. Rupp: Spirituosenanalytik. Behr, 2009, ISBN 3-89947-440-6, S. 313.
- ↑ A. Rapp, A. Markowetz: NMR-Spektroskopie in der Weinanalytik. In: Chemie in unserer Zeit. 27. Jahrg. 1993, Nr. 3, S. 149–155, doi:10.1002/ciuz.19930270307.
- ↑ C. Ford Runge, Benjamin Senauer: How Biofuels Could Starve the Poor. Council on Foreign Affairs, Mai/Juni 2007. Abgerufen am 22. März 2015.
- ↑ Evelyn Boos, Thomas Priermeier: Gewinnchance Klimawandel: Investitionsmöglichkeiten und Anlagestrategien. Linde Verlag, Wien 2008, ISBN 978-3-7093-0216-3, S. 81.
- ↑ § 50 BrStV Vergällung. In: www.steuernundabgaben.de.
- ↑ RIS - Vergällung von Alkohol (VO-Vergällung) - Bundesrecht konsolidiert, Fassung vom 07.01.2019. In: www.ris.bka.gv.at.
- ↑ Durchführungsverordnung (EU) Nr. 162/2013 der Kommission vom 21. Februar 2013. (PDF; 749 kB)
- ↑ Karl-Ludwig Haken: Grundlagen der Kraftfahrzeugtechnik. Hanser Verlag, 2007, ISBN 978-3-446-22812-2, S. 23.
- ↑ a b Eintrag zu Ethanol (Phase change data). In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD, abgerufen am 17. November 2019.
- ↑ CRC, S. 6–54, abgerufen am 22. März 2015.
- ↑ a b Per-Gunnar Jönsson: Hydrogen Bond Studies. CXIII The Crystall Structure of Ethanol at 87 K. In: Acta Cryst. Vol. 32, 1976, S. 232–235, doi:10.1107/S0567740876002653.
- ↑ E. W. Flick: Industrial Solvents Handbook. Fifth Edition, Noyes Data Corporation (ndc), Westwood, NJ/USA 1998, ISBN 0-8155-1413-1, S. 252.
- ↑ Naim Kosaric, Zdravko Duvnjak, Adalbert Farkas, Hermann Sahm, Stephanie Bringer-Meyer, Otto Goebel, Dieter Mayer: Ethanol. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley‐VCH Verlag, 15. Oktober 2011, doi:10.1002/14356007.a09_587.pub2.
- ↑ W. C. Coburn Jr., E. Grunwald: Infrared Measurements of the Association of Ethanol in Carbon Tetrachloride. In: J. Am. Chem. Soc. Vol. 80, Nr. 6, 1958, S. 1318–1322, doi:10.1021/ja01539a010.
- ↑ George Brink, Leslie Glasser: Studies in hydrogen bonding: the enthalpy of hydrogen bond formation of ethanol in carbon tetrachloride solutions. In: Journal of Molecular Structure. Vol. 145, 1986, S. 219–224, doi:10.1016/0022-2860(86)85026-8.
- ↑ Eintrag zu Diethylsulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. März 2015. (JavaScript erforderlich)
- ↑ Unterrichtsreihe zum Thema Eiweiß. (PDF; 355 kB) WWU Münster, Seminar: Schulorientiertes Experimentieren. WS 06/07; abgerufen am 22. März 2015.
- ↑ Standardanweisung Hygienische Händedesinfektion. ( vom 1. Juni 2010 im Internet Archive) Institut für Hygiene und Umweltmedizin, Universität Greifswald (PDF; 127 kB). Abgerufen am 22. März 2015.
- ↑ Alkoholische Getränke: Spirituosen. (MS Word; 47 kB) WIGL Lehrmittel; abgerufen am 22. März 2015.
- ↑ Wolfgang Staudt: 50 einfache Dinge, die Sie über Wein wissen sollten. Westend, 2007, ISBN 978-3-938060-04-9, S. 37.
- ↑ Nagl-Netzreport: Haltbarmachung von Lebensmitteln. ( vom 8. Oktober 2007 im Internet Archive) (PDF; 202 kB). Abgerufen am 22. März 2015.
- ↑ Hartspiritus. In: Lexikon der Chemie, Spektrum.de; abgerufen am 22. März 2015.
- ↑ a b H.-H. Frey, F. R. Althaus: Lehrbuch der Pharmakologie und Toxikologie für die Veterinärmedizin. Georg Thieme Verlag, 2007, ISBN 978-3-8304-1070-6, S. 469.
- ↑ H. Hof, R. Dörries: Medizinische Mikrobiologie. 3. Auflage. Georg Thieme Verlag, Stuttgart 2005, S. 686.
- ↑ Percutane Alkohol Injektion (PEI) der Schilddrüse. madeasy.de; abgerufen am 22. März 2015.
- ↑ P. Janowitz, S. Ackmann: Langzeitergebnisse der ultraschallgesteuerten Alkoholinstillation bei Patienten mit fokaler Schilddrüsenautonomie und Hyperthyreose. In: Medizinische Klinik, 2001, 96, S. 451; doi:10.1007/PL00002227.
- ↑ W. Caspary, U. Leuschner, S. Zeuzem: Therapie von Leber- und Gallekrankheiten. Springer, 2001, ISBN 3-540-67390-3, S. 365.
- ↑ Lynn Thorndike und Francis S. Benjamin Jr. (Hrsg.): The herbal of Rufinus. Chicago 1945 (= Corpus of mediaeval scientific texts, 1), S. 119
- ↑ Volker Zimmermann: Die beiden Harburger Syphilis-Traktate. In: Würzburger medizinhistorische Mitteilungen. Band 7, 1989, S. 71–81, hier: S. 76.
- ↑ Rudolf Frey, Otto Mayrhofer, mit Unterstützung von Thomas E. Keys und John S. Lundy: Wichtige Daten aus der Geschichte der Anaesthesie. In: R. Frey, Werner Hügin, O. Mayrhofer (Hrsg.): Lehrbuch der Anaesthesiologie und Wiederbelebung. Springer, Heidelberg/Basel/Wien 1955; 2., neubearbeitete und erweiterte Auflage. Unter Mitarbeit von H. Benzer. Springer-Verlag, Berlin/Heidelberg/New York 1971. ISBN 3-540-05196-1, S. 13–16, hier: S. 13.
- ↑ Alkohol-Dehydrogenase. Technische Universität Darmstadt, Institut für Anorganische Chemie, archiviert vom (nicht mehr online verfügbar) am 24. Februar 2008; abgerufen am 22. März 2015.
- ↑ a b Renewable ethanol: driving jobs, growth and innovation throughout Europe. State of the Industry. Report 2014. (PDF) 2014, archiviert vom (nicht mehr online verfügbar) am 16. Juni 2015; abgerufen am 22. März 2015.
- ↑ Braskem Ethanol-to-Ethylene Plant, Brazil. chemicals-technology.com; abgerufen am 22. März 2015.
- ↑ Eintrag zu Konservierung. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. März 2015.
- ↑ H. Lüllmann, L. Hein, K. Mohr, M. Wehling: Pharmakologie und Toxikologie. 16. Auflage, Georg Thieme Verlag, 2006, ISBN 978-3-13-368516-0, S. 521.
- ↑ K. Roth: Die Chemie des Katers: Alkohol und seine Folgen. In: Chemie in unserer Zeit. Vol. 41, 2007, S. 46–55, doi:10.1002/ciuz.200700409.
- ↑ W. Gerok, C. Huber, T. Meinertz, H. Henning Zeidler (Hrsg.): Die innere Medizin: Referenzwerk für den Facharzt. 11. Auflage, Schattauer Verlag, 2006, ISBN 978-3-7945-2222-4, S. 644–646.
- ↑ a b c H.-K. Biesalski, O. Adam: Ernährungsmedizin: Nach dem Curriculum Ernährungsmedizin der Bundesärztekammer. 3. Auflage, Georg Thieme Verlag, 2004, ISBN 978-3-13-100293-8, S. 520–528.
- ↑ a b P. Schauder, G. Ollenschläger: Ernährungsmedizin: Prävention und Therapie. Elsevier Deutschland, 2006, ISBN 978-3-437-22921-3, S. 162.
- ↑ Heinrich Kasper: Ernährungsmedizin und Diätetik. 10. Auflage, Elsevier, Urban & Fischer Verlag, 2004, ISBN 978-3-437-42011-5, S. 70.
- ↑ Eduard Burgis: Intensivkurs allgemeine und spezielle Pharmakologie. 4. Auflage, Elsevier, Urban & Fischer Verlag, 2008, ISBN 978-3-437-42613-1, S. 520.
- ↑ David J. Nutt, Leslie A. King, Lawrence D. Phillips: Drug harms in the UK: a multicriteria decision analysis. In: The Lancet. Band 376, Nr. 9752, 6. November 2010, S. 1558–1565, doi:10.1016/S0140-6736(10)61462-6, PMID 21036393.
- ↑ Robert Gable: Drug Toxicity. Abgerufen am 17. Februar 2011.
- ↑ R. S. Gable: Acute toxicity of drugs versus regulatory status. In: J. M. Fish (Hrsg.): Drugs and Society. U.S. Public Policy. Rowman & Littlefield Publishers, Lanham, MD 2006, ISBN 0-7425-4244-0, S. 149–162.
- ↑ Ekkehard Grundmann (Hrsg.): Spezielle Pathologie. Lehrbuch. Bgr. v. Franz Büchner. 7., neu bearb. Auflage. München / Wien / Baltimore 1986, ISBN 3-541-00467-3, S. 258.
- ↑ E. Grundmann (Hrsg.): Spezielle Pathologie. Lehrbuch. Bgr. v. Franz Büchner. 7., neu bearb. Auflage. München / Wien / Baltimore 1986, ISBN 3-541-00467-3, S. 75.
- ↑ K.-H. Niessen (Hrsg.): Pädiatrie. 3., neubearbeitete Auflage. Weinheim / Basel / Cambridge / New York 1993, ISBN 3-527-15517-1, S. 64.
- ↑ W. Forth u. a. (Hrsg.): Allgemeine und spezielle Pharmakologie und Toxikologie. Für Studenten der Medizin, Veterinärmedizin, Pharmazie, Chemie, Biologie sowie für Ärzte, Tierärzte und Apotheker. 6., völlig neu bearb. Auflage. Mannheim / Leipzig / Wien / Zürich 1992, ISBN 3-411-15026-2, S. 798.
- ↑ Manfred V. Singer, Stephan Teyssen: Serie – Alkoholismus: Moderater Alkoholkonsum – Gesundheitsförderlich oder schädlich? Deutsches Ärzteblatt 2002; 99 (16), S. A-1103/B-916/C-858.
- ↑ Beim Alkoholkonsum gibt es keine gesundheitlich unbedenkliche Menge. Abgerufen am 18. Februar 2024.
- ↑ Dirk Lachenmeier: „Warning Labels“ statt „Health Claims“? IARC Neubewertung von Ethanol in alkoholischen Getränken als „Gruppe-1-Karzinogen“ ( vom 11. April 2014 im Internet Archive). Conference presentation at the Deutscher Lebensmittelchemikertag 2007.
- ↑ IARC Monographs on the Evaluation of Carcinogenic Risks to Humans Volume 44: Alcohol Drinking (PDF; 34 kB) World Health Organization, iarc.fr
- ↑ Global Status Report on Alcohol and Health 2014. (PDF) who.int, abgerufen am 16. August 2014.
- ↑ Mann mit knapp 7,7 Promille aufgefunden. Tagesspiegel.de, 11. November 2008; abgerufen am 22. März 2015.
- ↑ A. Chandrakumar, A. Bhardwaj, G. W. 't Jong: Review of thiamine deficiency disorders: Wernicke encephalopathy and Korsakoff psychosis. In: Journal of basic and clinical physiology and pharmacology. Band 30, Nummer 2, Oktober 2018, S. 153–162, doi:10.1515/jbcpp-2018-0075, PMID 30281514.
- ↑ Holly A. Stankewicz: Alcohol Related Psychosis. In: ncbi.nlm.nih.gov. 23. Dezember 2018, abgerufen am 21. April 2019 (englisch).
- ↑ W. J. Moore, D. O. Hummel: Physikalische Chemie. Walter de Gruyter, Berlin/New York 1983, ISBN 978-3-11-008554-9, S. 958.
- ↑ M. Hesse, H. Meier, B. Zeeh: Spektroskopische Methoden in der organischen Chemie. Thieme, Stuttgart 2005, ISBN 3-13-576107-X, S. 40–44.

