Esculetin ist ein Cumarin-Derivat. In der Natur kommt es unter anderem in Eschenrinde (Cortex Fraxini) vor, welche in der traditionellen chinesische Medizin eingesetzt wird. Die pharmakologische Wirkung der Eschenrinde beruht dabei unter anderem auf dem Vorhandensein von Esculetin und seines Glycosid Aesculin.[3]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
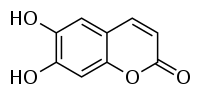
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Esculetin | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C9H6O4 | ||||||||||||||||||
| Kurzbeschreibung |
hellgelber Feststoff[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 178,14 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Wirkung
BearbeitenEsculetin ist ein Antioxidans und kann dadurch DNA vor Schädigung durch oxidativen Stress schützen. Diese Wirkung konnte z. B. in Versuchen mit Zellkulturen gezeigt werden. Esculetin war dabei in der Lage reaktive Sauerstoffspezies (ROS), welche durch UV-Licht gebildet werden können, abzufangen. Diese Beobachtung legt eine vorbeugende Wirkung von Esculetin gegen Hautkrebs nahe.[4] Esculetin-haltige Naturheilmittel werden außerdem in der Volksmedizin gegen Leberschäden eingesetzt. Eine vorbeugende Wirkung von Esculetin gegen Leberschäden durch Paracetamol konnte in Experimenten mit Mäusen tatsächlich nachgewiesen werden.[5] Die leberschützende Wirkung beruht vermutlich auf der Reaktion von Esculetin mit den, durch das Leberenzym Cytochrom P450 gebildeten, freien Radikalen.[6] Weitere mögliche Wirkungen gegen u. a. Diabetes, Adipositas oder Leukämie konnten in Tier- und Zellkultur-Experimente festgestellt werden.[3]
Synthese
BearbeitenSynthetisch kann Esculetin ausgehend von p-Benzochinon hergestellt werden. Dieses wird zunächst in einer 1,4-Addition mit Essigsäureanhydrid zu Hydroxyhydrochinontriacetat umgesetzt. Letzteres reagiert mit Äpfelsäure zu Esculetin.[7] Beide genannten Teilreaktionen benötigen Schwefelsäure als Katalysator.
Eine weitere Synthesemöglichkeit besteht in der Umsetzung von Hydroxyhydrochinon mit Propiolsäureethylester. Bei dieser Reaktion fungiert Zinkchlorid als Katalysator.[8]
Einzelnachweise
Bearbeiten- ↑ Eintrag zu ESCULETIN in der CosIng-Datenbank der EU-Kommission, abgerufen am 22. Oktober 2021.
- ↑ a b c d e Datenblatt 6,7-Dihydroxycoumarin, 98% bei Sigma-Aldrich, abgerufen am 20. Januar 2017 (PDF).
- ↑ a b Mao, G., Zhang, S., Song, H., Ding, S., Zhu, P., Wang, X., Liang, C.: Synthesis, biological activities and therapeutic properties of esculetin and its derivatives. In: JOCPR. Band 7, Nr. 4, 2015, S. 122–130 (PDF).
- ↑ Kaneko, T., Tahara, S., Takaba, F.: Suppression of Lipid Hydroperoxide-Induced Oxidative Damage to Cellular DNA by Esculetin. In: Biol Pharm Bull. Band 26, Nr. 6, 2003, S. 840–844, doi:10.1248/bpb.26.840 (PDF).
- ↑ Gilani, A. H., Janbaz, K. H., Shah, B. H.: Esculetin prevents liver damage induced by paracetmaol and CCl4. In: Pharmacol Res. Band 37, Nr. 1, 1998, S. 31–35, doi:10.1006/phrs.1997.0262.
- ↑ Lin, W.-L., Wang, C.-J., Yu-Ying, T., Liu, C.-L., Hwang, J.-M., Tseng, T.-H.: Inhibitory effect of esculetin on oxidative damage inducedby t-butyl hydroperoxide in rat liver. In: Arch. Toxicol. Band 74, 2000, S. 467–472, doi:10.1007/s002040000148.
- ↑ Cao, W. Q.; Xue, J. F.; Shi, C. M.; Ding, C. F.; Zhu, X. G.; Liu, F.; Zhou, X. J.: 6,7-Dihydroxycoumarine. In: Fine Chem. Intermed. Band 43, Nr. 3, 2013, S. 39–41 (chinesisch).
- ↑ Yang, X. J.; Gao, H. H.: Study on the synthesis of esculetin under microwave irradiation. In: Appl. Chem. Ind. Band 40, Nr. 4, 2011, S. 627–629 (chinesisch, englisches Abstract).
