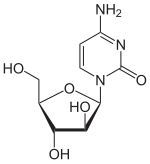
Cytarabin (araC) ist ein Isomer des Nukleosids Cytidin. Es besteht aus einer Furanose (Zucker) und dem Cytosin. Es enthält – im Gegensatz zu den meisten Nukleosiden – anstelle der β-D-Ribofuranose die β-D-Arabinofuranose und gehört damit zur Gruppe der Arabinosylnukleoside. Es wird als Zytostatikum (Antimetabolit) zur wachstumshemmenden Behandlung bei Krebserkrankungen eingesetzt. Darüber hinaus besitzt Cytarabin auch virushemmende Eigenschaften, wird aber als Virostatikum nur sehr selten eingesetzt.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Cytarabin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C9H13N3O5 | |||||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 243,17 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt |
212–213 °C[1] | |||||||||||||||||||||
| Löslichkeit |
löslich in Wasser[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Wirkungsmechanismus
BearbeitenCytarabin wirkt als falscher Baustein der DNA. Nach Umwandlung (Phosphorylierung) in seine aktive Form Cytosinarabinosidtriphosphat wird es anstelle des Nukleotids Cytidintriphosphat in die DNA während der DNA-Replikation eingebaut. Daneben werden auch die DNA-Reparaturmechanismen blockiert. Cytarabin wirkt fast ausschließlich während der S-Phase des Zellzyklus zytotoxisch.
Pharmakokinetik
BearbeitenAufnahme und Bioverfügbarkeit
BearbeitenEine Dosis von Cytarabin wird bei oraler Gabe zu weniger als 20 % in den Blutkreislauf aufgenommen. Bei intravenöser oder subkutaner Verabreichung ist Cytarabin liquorgängig (Liquor-Plasma-Ratio 14 % i. v. Bolus, 40–60 % i. v. Infusion oder s. c. Injektion). Die Plasmaproteinbindung von Cytarabin beträgt 13 %. Das Verteilungsvolumen von Cytarabin wurde mit 3,0 ± 1,9 l/kg Körpergewicht bestimmt.
Verstoffwechselung (Metabolismus)
BearbeitenCytarabin wird zu Cytosin-Arabinosid-Triphosphat (aktiv) und Uracil-Arabinosid (inaktiv) in der Leber verstoffwechselt.
Ausscheidung (Elimination)
BearbeitenExtensive Verstoffwechselung über Cytosin-Deaminasen der Leber und Nieren.
Anwendungsgebiete
BearbeitenCytarabin wird vor allem zur Behandlung der akuten myeloischen Leukämie (AML) bei Kindern und Erwachsenen eingesetzt. Bei der AML-Behandlung ist Cytarabin eines der wichtigsten Cytostatika. Neben der AML wird mit Cytarabin auch die akute lymphoblastische Leukämie (ALL) bei Kindern und Erwachsenen behandelt.
Die Wirksamkeit von Cytarabin bei akuten Leukämien wurde 1968 erstmals in einer größeren wissenschaftlichen Veröffentlichung beschrieben.[4] In dieser Studie wurden 116 Patienten mit rezidivierter akuter Leukämie (15 ALL, 77 AML oder akuter biphänotypischer Leukämie) mit Cytosin-Dauerinfusionen über 12 oder 24 Stunden in einer Dosierung von 30 mg/m² Körperoberfläche (KÖF) und Tag für eine Woche, oder alternativ als 1-Stunden-Infusionen von 50 oder 100 mg/m² KÖF und Tag behandelt. Die durchschnittliche Remissionsrate bei AML lag bei etwa 25 % und war damit höher als bei jedem anderen damals bekannten Medikament. Das 1-Jahres-Überleben insbesondere der Patienten, die auf das Medikament ansprachen, war deutlich verbessert. Cytarabin ist bis heute Grundbestandteil fast jeder AML-Chemotherapie geblieben. Besonders geläufig ist das „7+3-Schema“ (7 Tage Cytosin 100 mg/m²/Tag-Dauerinfusion und an 3 Tagen zusätzlich ein Anthracyclin).[5]
Eine Besonderheit von Cytarabin ist die Fähigkeit, die Blut-Hirn-Schranke insbesondere bei der Verabreichung hoher Dosierungen (>1000 mg/m2 Körperoberfläche pro Einzeldosis) zu passieren und somit im Gehirn gegenüber Leukämiezellen wirksam zu sein. Cytarabin kann darüber hinaus allein oder in Kombination mit Prednison und Methotrexat (sogenanntes Triple) auch direkt in das Gehirnwasser verabreicht werden (intrathekale Gabe).
Erwachsene
Bearbeiten- Akute myeloische Leukämie (AML)
- Akute lymphatische Leukämie (ALL)
- Myelodysplastisches Syndrom (MDS)
- Non-Hodgkin-Lymphom (NHL)
Kinder und Jugendliche
Bearbeiten- Akute myeloische Leukämie (AML)
- Akute lymphatische Leukämie (ALL). Cytarabin kann bei der Behandlung der ALL sowohl bei der Ersterkrankung als auch im Falle eines Rückfalls (Rezidiv) eingesetzt werden.
- Myelodysplastisches Syndrom (MDS)
- Non-Hodgkin-Lymphom (NHL)
Dosis und Verabreichung
BearbeitenErwachsene
Bearbeiten- Akute myeloische Leukämie (AML)
- Akute lymphatische Leukämie (ALL)
- Myelodysplastisches Syndrom (MDS)
- Non-Hodgkin-Lymphom (NHL)
Kinder und Jugendliche
Bearbeiten- Akute myeloische Leukämie (AML)
- Akute lymphatische Leukämie (ALL). Cytarabin wird vor allem in Kombination mit anderen Zytostatika hochdosiert in der Konsolidierungsbehandlung der ALL eingesetzt. Die hierbei verwendete Dosierung ist 3000 mg/m2 Körperoberfläche pro Einzeldosis als i. v. Infusion mit 3 Stunden Laufzeit. 4 Einzeldosen von Cytarabin werden dabei binnen 48 Stunden im Abstand von jeweils 12 Stunden verabfolgt. Diese Kombinationschemotherapie wird bei gleichzeitigem Einsatz von Asparaginase nach Ende der Cytarabin-Infusionen auch als HIDAC-Block bezeichnet.
- Myelodysplastisches Syndrom (MDS)
- Non-Hodgkin-Lymphom (NHL). Cytarabin wird vor allem in Kombination mit anderen Zytostatika hochdosiert in der Konsolidierungsbehandlung der hochmalignen B- und T-Zell-Non-Hodgkin-Lymphome im Kindes- und Jugendalter eingesetzt. Eine bei der Behandlung der hochmalignen T-Zell-NHL verwendete Dosierung ist 3000 mg/m2 Körperoberfläche pro Einzeldosis als i. v. Infusion mit 3 Stunden Laufzeit. 4 Einzeldosen von Cytarabin werden dabei binnen 48 Stunden im Abstand von jeweils 12 Stunden verabfolgt. Diese Kombinationschemotherapie wird bei gleichzeitigem Einsatz von Asparaginase nach Ende der Cytarabin-Infusionen auch als HIDAC-Block bezeichnet.
Nebenwirkungen
Bearbeiten- Knochenmarkdepression (Myelotoxizität) mit Anämie, Thrombopenie und Leukopenie (Neutropenie). Dabei fällt in der Regel die Knochenmarkdepression umso schwerer aus, je höher die Dosis von Cytarabin ist.
- Neurotoxizität. Bei hohen Dosierungen von Cytarabin kann es zu einer (zeitweiligen) Schädigung des Kleinhirns kommen (Cerebellitis). Bei intrathekaler Gabe ist eine nicht-infektiöse (chemisch bedingte) Reizung (Entzündung) der Hirnhäute möglich (Meningitis, Arachnoiditis).
- Bindehautentzündung (Konjunktivitis). Bei hoher Dosierung von Cytarabin können Bindenhautentzündungen (Konjunktivitis) auftreten.
- Übelkeit und Erbrechen
- Schleimhautschädigung (Mukositis)
- Haarausfall (Alopezie)
- Luftnot und Akutes Atemnotsyndrom (Dyspnoe und ARDS)
- Leberschädigung (Hepatotoxizität)
Gegenanzeigen (Kontraindikationen)
BearbeitenHandelsnamen
BearbeitenAlexan (A), Cytosar (CH), DepoCyte (A, CH), diverse Generika (A, D).
Vyxeos (Kombination mit Daunorubicin; D)[6]
Literatur
Bearbeiten- Seymour S. Cohen: The mechanisms of lethal action of arabinosyl cytosine (araC) and arabinosyl adenine (araA). In: Cancer. 40(1 Suppl), Jul 1977, S. 509–518. PMID 328134.
Weblinks
Bearbeiten- Eintrag zu Cytarabine in der Human Metabolome Database (HMDB), abgerufen am 16. Oktober 2013.
- BC Cancer Agency: Cytarabin
Einzelnachweise
Bearbeiten- ↑ a b c Datenblatt 1-β-D-Arabinofuranosylcytosine (PDF) bei Calbiochem, abgerufen am 8. Dezember 2015.
- ↑ a b Datenblatt Cytosine β-D-arabinofuranoside bei Sigma-Aldrich, abgerufen am 29. Mai 2022 (PDF).
- ↑ a b Eintrag zu Cytarabine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 5. Januar 2022. (Seite nicht mehr abrufbar)
- ↑ R. R. Ellison, J. F. Holland, M. Weil, C. Jacquillat, M. Boiron, J. Bernard, A. Sawitsky, F. Rosner, B. Gussoff, R. T. Silver, A. Karanas, J. Cuttner, C. L. Spurr, D. M. Hayes, J. Blom, L. A. Leone, F. Haurani, R. Kyle, J. L. Hutchinson, R. J. Forcier, J. H. Moon: Arabinosyl cytosine: a useful agent in the treatment of acute leukemia in adults. In: Blood. 32(4), 1968, S. 507–523 (PDF).
- ↑ U. Krug, T. Büchner, W. E. Berdel, C. Müller-Tidow: Behandlung älterer Patienten mit akuter myeloischer Leukämie. In: Dtsch Arztebl. 108(51–52), 2011, S. 863–870 (PDF).
- ↑ Fachinfo. Abgerufen am 6. Oktober 2020 (englisch).