Chlor(methyl)silan ist eine chemische Verbindung aus der Stoffklasse der Silane. Sie besteht aus einem zentralen Siliciumatom, um welches tetraedrisch zwei Wasserstoffatome und jeweils ein Chloratom und ein Methylrest koordiniert sind.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
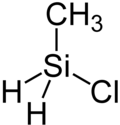
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Chlor(methyl)silan | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | CH5ClSi | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 80,59 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte |
0,94 g·cm−3 (−80 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck |
724 hPa bei 0 °C[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Darstellung
BearbeitenChlor(methyl)silan kann durch die Chlorierung von Methylsilan mit Chlorwasserstoff in Gegenwart von Aluminiumchlorid als Katalysator bei erhöhter Temperatur hergestellt werden.[1] Als Nebenprodukt entsteht Dichlor(methyl)silan.
Eigenschaften
BearbeitenEs handelt sich um eine bei Raumtemperatur gasförmige Verbindungen, die sich bei −46 °C (bei 13 hPa) verflüssigt und bei −135 bis −134 °C erstarrt.
Verwendung
BearbeitenChlor(methyl)silan kann zur Herstellung von organischen Silanen dienen. Der Chlorsubstituent dient hierbei als Abgangsgruppe und kann in einer Substitutionsreaktion durch Nukleophile ausgetauscht werden. Als Nukleophile können beispielsweise Grignard-Verbindungen[4] oder Organolithium-Verbindungen[5] verwendet werden.
Quellen
Bearbeiten- ↑ a b c d A. Stock, C. Somieski: Siliciumwasserstoffe VI.: Chlorierung und Methylierung des Monosilans, in: Chem. Ber. 1919, 52, 710; doi:10.1002/cber.19190520410.
- ↑ E. Hengge, W. Kalchauer: Neue Wege zu Polysilanen, in: Monatsh. Chem. 1990, 121, 793–802.
- ↑ a b Eintrag zu Methylchlorsilan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 6. Januar 2016. (JavaScript erforderlich)
- ↑ E. Lukevics, R. Sturkovich, Y. Goldberg, A. Gaukhman: Reactions of heteroarylhydrosilanes with dichlorocarbene under phase-transfer conditions, in: J. Organomet. Chem. 1988, 345, 19–25.
- ↑ E. Lukevics, V. Ryabova, P. Arsenyan, S. Belyakov, J. Popelis, O. Pudova: Bithienylsilanes: unexpected structure and reactivity, in: J. Organomet. Chem. 2000, 610, 8–15.


