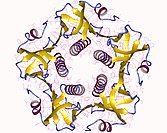
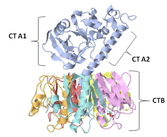
Das Choleratoxin (CTX, auch CT) ist ein von dem Bakterium Vibrio cholerae (sowohl vom klassischen Biovar wie auch vom Biovar El Tor) produziertes Exotoxin, das beim Menschen eine schwere Durchfallerkrankung auslösen kann.[1] Das Enterotoxin ist Auslöser der Cholera. Es wurde 1959 von Sambhu Nath De entdeckt.
| Choleratoxin, Untereinheit A | ||
|---|---|---|
|
Vorhandene Strukturdaten: s. UniProt | ||
| Masse/Länge Primärstruktur | 242 = 194+46 Aminosäuren | |
| Sekundär- bis Quartärstruktur | α1+α2 | |
| Bezeichner | ||
| Gen-Name(n) | ctxA (KEGG) | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 2.4.2.36, Transferase | |
| Reaktionsart | Übertragung eines ADP-Ribosylrests | |
| Substrat | NAD+ + Peptid-Diphtamid | |
| Produkte | Nicotinamid + Peptid-N-ADP-Ribosyldiphtamid | |
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Choleratoxin, Untereinheit B | ||
|---|---|---|
|
Vorhandene Strukturdaten: s. UniProt | ||
| Masse/Länge Primärstruktur | 103 Aminosäuren | |
| Bezeichner | ||
| Gen-Name(n) | ctxB (KEGG) | |
| Externe IDs | ||
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
Wirkungsmechanismus
BearbeitenDas Choleratoxin ist ein hexameres Protein mit einer molekularen Masse von 84 kDa, das aus einer α- (A) und fünf β-Untereinheiten (B) aufgebaut ist.[2] Hierbei wird die α-Untereinheit von einem Pentamer (β-Untereinheit) ringförmig umgeben (AB5). Die β-Untereinheit ermöglicht das Binden an GM1 Gangliosid-Rezeptoren an der Oberfläche von Zellen der Darmschleimhaut.[2] Dies erlaubt die Endozytose in die Zelle, im ER wird dann die α-Untereinheit freigesetzt.
Die α-Untereinheit (CTA1) ist für die Toxizität verantwortlich. Sie hemmt die GTPase-Aktivität der Gαs-Untereinheit eines heterotrimeren G-Proteins, indem es diese (aus intrazellulärem NAD+) ADP-ribosyliert. Dadurch wird die intrinsische GTPase-Aktivität der Gαs-Untereinheit, die GTP zu GDP umsetzt, blockiert – das G-Protein bleibt im aktiven Zustand. Es aktiviert nun permanent die Adenylatcyclase, es kommt zu einem Überschuss des Second Messengers cAMP. Damit wird die Aktivität bestimmter Membrankanäle verändert. Die Folge ist eine Ausschüttung von Chlorid und Bicarbonaten, wodurch der Wasserverlust resultiert.[2] Dies führt zu den typischen Durchfällen.
Pathophysiologische Wirkung auf das Darmepithel
BearbeitenDas dauerhaft vermehrte cAMP führt zu verstärktem Einbau des Chloridkanals Cystic Fibrosis Transmembrane Conductance Regulator (CFTR) in die Membran und dadurch zu erhöhtem Verlust von Chloridionen (Cl−) in das Lumen. Zusätzlich kommt es zu einem Na+-Verlust durch Hemmung des Na+/H+-Austauschers (NHE3) und des Na+-Kanals (Epithelialer Natriumkanal, ENaC), der für die Na+-Rückresorption ins Epithel zuständig ist. Außerdem geht man davon aus, dass die Tight-Junctions-Durchlässigkeit zwischen den Epithelzellen zunimmt. Als Folge ergeben sich Dehydratisierung und Elektrolytmangel durch Verlust von NaCl und Entzug von H2O aus dem Epithel, das dem NaCl passiv ins Darmlumen folgt. Es kann zu starken Durchfällen mit Wasserverlusten von bis zu einem Liter pro Stunde kommen, ebenfalls zu massivem Ausstrom von Kalium- und Hydrogencarbonat-Ionen über den Darm.
Dies führt insgesamt zum Krankheitsbild der Cholera. Das Choleratoxin ist Bestandteil eines Choleraimpfstoffs.
Literatur
Bearbeiten- Bruce Alberts, A. Johnson, J. Lewis, M. Raff, K. Roberts, P.Walter: Molecular Biology of the Cell. Fifth edition, reference edition, Garland Science, New York 2008.
Weblinks
Bearbeiten- Cholera Enterotoxin Vibrio cholerae – VC1457 in der Kyoto Encyclopedia of Genes and Genomes (KEGG)
Einzelnachweise
Bearbeiten- ↑ Joaquín Sánchez, Jan Holmgren: Cholera toxin – A foe & a friend. In: The Indian Journal of Medical Research. Band 133, Nr. 2, Februar 2011, ISSN 0971-5916, S. 153–163, PMID 21415489, PMC 3089046 (freier Volltext).
- ↑ a b c John D. Clemens et al.: Cholera Vaccines. In: Stanley A. Plotkin et al. (Hrsg.): Plotkin’s Vaccines. 7. Auflage. Elsevier, Philadelphia 2017, ISBN 978-0-323-35761-6, S. 186, doi:10.1016/B978-0-323-35761-6.00014-6.