N,N-Dimethylethanolamin
N,N-Dimethylethanolamin ist eine organisch-chemische Verbindung aus der Stoffgruppe der alkylierten Aminoalkohole. Es ist über das Cholin (das Trimethylethanolammonium-Kation) eng mit dem Neurotransmitter Acetylcholin verwandt. Die Verbindung ist ein Zwischenprodukt der chemischen und pharmazeutischen Industrie.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
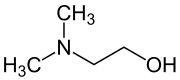
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Deanol | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C4H11NO | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit ammoniakartigem Geruch[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 89,14 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig[2] | |||||||||||||||||||||
| Dichte |
0,89 g·cm−3 (20 °C)[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
131 °C[2] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Brechungsindex |
1,4300 (20 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Vorkommen
BearbeitenAls Stoffwechselprodukt des Metabolismus des Cholins kommt Dimethylaminoethanol in vielen Lebewesen vor. Größere Mengen findet man in Fischen (Sardine, Lachs, Anchovis).
Gewinnung und Darstellung
BearbeitenN,N-Dimethylethanolamin wird technisch durch Umsetzung von Dimethylamin mit Ethylenoxid bei Temperaturen von 125–160 °C und Drücken von 15–30 bar in Gegenwart katalytischer Mengen an Wasser in flüssigkeitsgekühlten Doppelmantelrohrreaktoren hergestellt.[5]
Die Reinigung und Aufarbeitung des Produkts erfolgt durch mehrstufige Destillation in Rektifikationskolonnen.[5]
Des Weiteren kann Dimethylaminoethanol durch Methylierung von Monoethanolamin synthetisiert werden.
Eigenschaften
BearbeitenDer Flammpunkt liegt bei 31 °C, die Zündtemperatur bei 220 °C.[2]
Verwendung
BearbeitenDimethylaminoethanol findet als Hilfsmittel zur Dispergierung von Farbpigmenten in Wasserlacken Verwendung. Des Weiteren wird es als Zwischenprodukt bzw. Ausgangsstoff für die Herstellung von Farbstoffen, Emulgatoren, Korrosionsschutzmitteln, Textilhilfsmitteln, Kosmetika und Pharmazeutika benötigt.
Dimethylaminoethanol werden eine Vielzahl positiver Wirkungen, so unter anderem nootropische Effekte, nachgesagt, für die jedoch eindeutige Belege fehlen. Bei Alzheimer-Patienten wurden keine einheitlichen Ergebnisse beobachtet.[6][7] Ein Autor berichtet von vermehrten Klarträumen nach der Anwendung von DMAE.[8]
Dimethylaminoethanol als topisches Gel soll die Faltenbildung reduzieren.[9][10]
Sicherheitshinweise
BearbeitenAls tertiäres Amin ist Dimethylaminoethanol eine starke Base, worauf auch die ätzende Wirkung beruht. Es ist von nur geringer akuter Toxizität (LD50 (Ratte, oral): 2,00 g/kg, LD50 (Kaninchen, dermal): 1,37 g/kg).
Literatur
Bearbeiten- National Institute of Environmental Health Sciences: Dimethylethanolamine (DMAE) [108-01-0] and Selected Salts and Esters. Review of Toxicological Literature (Update), November 2002
Handelsnamen
BearbeitenRisatarun (D, außer Handel, Zulassung wurde nicht erteilt wegen fehlender Langzeitstudien)
Pharmaton Vital Geriavit (CH), Vita Gerin (D)
Einzelnachweise
Bearbeiten- ↑ Eintrag zu DIMETHYL MEA in der CosIng-Datenbank der EU-Kommission, abgerufen am 21. März 2020.
- ↑ a b c d e f g h i j k l m Eintrag zu 2-(Dimethylamino)ethanol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-198.
- ↑ Eintrag zu 2-dimethylaminoethanol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b Patent EP2651861B1: Verfahren zur Herstellung eines N,N-Dialkylethanolamins mit hoher Farbstabilität. Veröffentlicht am 25. Februar 2015, Anmelder: BASF SE, Erfinder: Frank-Friedrich Pape, Johann-Peter Melder, Alfred Krause, Roland Bou Chedid, Martin Rudloff.
- ↑ M. Fisman, H. Mersky, E. Helmes: Double-blind trial of 2-dimethylaminoethanol in Alzheimer's disease. In: The American journal of psychiatry. Band 138, Nummer 7, Juli 1981, S. 970–972, PMID 7020434.
- ↑ Carl C. Pfeiffer, Elizabeth H. Jenney, William Gallagher, Richard P. Smith, William Bevan, Keith F. Killam, Eva King Killam, William Blackmore: Stimulant effect of 2-dimethylaminoethanol; possible precursor of brain acetylcholine. In: Science. Band 126, Nummer 3274, September 1957, S. 610–611, PMID 13467254.
- ↑ W. Sergio: Use of DMAE (2-dimethylaminoethanol) in the induction of lucid dreams. In: Medical Hypotheses. 26, 1988, S. 255–257, doi:10.1016/0306-9877(88)90129-6.
- ↑ R. Grossman: The role of dimethylaminoethanol in cosmetic dermatology. In: American Journal of Clinical Dermatology. Band 6, Nummer 1, 2005, S. 39–47, PMID 15675889. (Review).
- ↑ I. Uhoda, N. Faska, C. Robert, G. Cauwenbergh, G. E. Piérard: Split face study on the cutaneous tensile effect of 2-dimethylaminoethanol (deanol) gel. In: Skin Research and Technology. Band 8, Nummer 3, August 2002, S. 164–167, PMID 12236885.


