Dichlor(phenyl)phosphan
Dichlorphenylphosphan ist eine chemische Verbindung aus der Gruppe der Phosphane. Sie trägt einen Phenylrest und zwei Chloratome am zentralen Phosphor gebunden.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
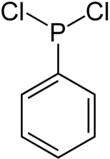
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Dichlor(phenyl)phosphan | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H5Cl2P | ||||||||||||||||||
| Kurzbeschreibung |
farblose bis leicht gelbliche Flüssigkeit mit sehr charakteristischem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 178,99 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
225 °C[1] | ||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Brechungsindex |
1,5962[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Herstellung
BearbeitenZur Synthese von Dichlorphenylphosphan kann die Reaktion zwischen Phosphortrichlorid mit Benzol in Gegenwart von Aluminiumchlorid genutzt werden.[5] Die Reaktion verläuft analog einer Friedel-Crafts-Acylierung. Die Lewis-Säure Aluminiumchlorid aktiviert zunächst Phosphortrichlorid und ermöglicht so den folgenden elektrophilen Angriff an das Benzol.
- Reaktion von Phosphortrichlorid mit Benzol zu Dichlorphenylphosphan. Ph=Phenyl. Der als Nebenprodukt gebildete Chlorwasserstoff entweicht als Gas aus dem Reaktionsgemisch.
Eigenschaften
BearbeitenDichlorphenylphosphan ist eine farblose Flüssigkeit, die öfters durch Verunreinigungen gelblich verfärbt und schon in geringen Konzentrationen durch ihren äußerst charakteristischen Geruch wahrnehmbar ist. Mit Wasser zersetzt sie sich langsam unter Bildung von Chlorwasserstoff.
Verwendung
BearbeitenDichlorphenylphosphan kann zur Synthese von Chlordiphenylphosphan verwendet werden. Bei Temperaturen über 280 °C disproportioniert Dichlorphenylphosphan zu Chlordiphenylphosphan und Phosphortrichlorid.[6]
- Disproportionierung von Dichlorphenylphosphan in Chlordipenylphosphan und Phosphortrichlorid.
Die Reduktion der Verbindung mittels Lithiumaluminiumhydrid in Diethylether ergibt das Phenylphosphan.[7]
Bei der Umsetzung mit elementarem Chlor entsteht Tetrachlorphenylphosphoran, welches unter anderem dazu in der Lage ist aromatische Hydroxy-Gruppen direkt durch Chloratome zu substituieren.[8]
Einzelnachweise
Bearbeiten- ↑ a b c d e f g h Eintrag zu Dichlor(phenyl)phosphin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ A. Michaelis: Ueber die Verbindungen der Elemente der Stickstoffgruppe mit den Radicalen der aromatischen Reihe. In: Justus Liebigs Annalen der Chemie. Band 181, Nr. 3, 1876, S. 265–363, doi:10.1002/jlac.18761810302.
- ↑ Georg Wittig, Helmut Braun, Henri-Jean Cristau: Darstellung und Racematspaltung chiraler Triarylphosphine. In: Justus Liebigs Annalen der Chemie. Band 751, Nr. 1, 12. Oktober 1971, S. 17–26, doi:10.1002/jlac.19717510103.
- ↑ Datenblatt Dichlorphenylphosphin bei Merck, abgerufen am 24. März 2011.
- ↑ F Simeon, P.-A Jaffres, D Villemin: A direct and new convenient oxidation: synthesis of substituted arylphosphonates from aromatics. In: Tetrahedron. Band 54, Nr. 34, 1998, S. 10111–10118.
- ↑ A. Broglie: Ueber das Verhalten von Phosphenylchlorid bei höherer Temperatur. In: Berichte der deutschen chemischen Gesellschaft. Band 10, Nr. 1, 1877, S. 628, doi:10.1002/cber.187701001174.
- ↑ Leon D. Freedman, G. O. Doak: The Reduction of Benzenephosphonyl Dichloride. In: Journal of the American Chemical Society. Band 74, Nr. 13, Juli 1952, S. 3414–3415, doi:10.1021/ja01133a504.
- ↑ Elliott Bay, David A. Bak, Peter E. Timony, Andrea Leone-Bay: Preparation of aryl chlorides from phenols. In: The Journal of Organic Chemistry. Band 55, Nr. 10, Mai 1990, S. 3415–3417, doi:10.1021/jo00297a087.

