Chrom(III)-oxid
Chrom(III)-oxid, Cr2O3, ist eine chemische Verbindung aus Chrom und Sauerstoff. Es wird oft nur Chromoxid genannt, obwohl dieser Name zu Verwechslungen mit den drei anderen Chromoxiden Chrom(II)-oxid, Chrom(IV)-oxid und Chrom(VI)-oxid führen kann.
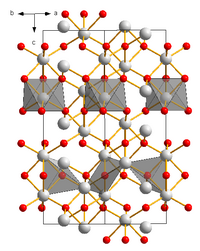
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| _ Cr3+ _ O2− | |||||||||||||||||||
| Kristallsystem |
Hexagonal | ||||||||||||||||||
| Raumgruppe |
R3c (Nr. 167) | ||||||||||||||||||
| Gitterparameter |
a = 0.496 nm, c = 1.359 nm | ||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Chrom(III)-oxid | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Verhältnisformel | Cr2O3 | ||||||||||||||||||
| Kurzbeschreibung |
grünes, geruchloses Pulver[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 151,99 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
5,21 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
~3000 °C[3] | ||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Als synthetisch hergestelltes Pigment Chromoxidgrün wurde es 1929 von der Bayer AG auf den Markt gebracht.[5]
Vorkommen
BearbeitenIn der Natur ist Chrom(III)-oxid als selten vorkommendes Mineral Eskolait bekannt.
Eigenschaften
BearbeitenChrom(III)-oxid liegt je nach Herstellungsmethode als grünes Pulver oder als buntschillernde, metallartig glänzende, sehr harte, hexagonal rhomboedrische Kristalle vor.[3] Chrom(III)-oxid ist (im Gegensatz zum gefährlichen Chrom(VI)-oxid) ungiftig.[6]
Chrom(III)-oxid hat eine Bandlücke von 3.2 eV[7] und müsste in reiner Form somit ein Isolator sein. Die beobachteten halbleitenden Eigenschaften von Dünnfilmen[8][9] lassen sich dadurch erklären, dass einzelne fehlende Chromatome ein neues Akzeptorband erzeugen[10]. Dieser elektronische Zustand ermöglicht Löcherleitung und macht Chrom(III)-oxid zu einem p-Typ Halbleiter.
Verwendung
BearbeitenChrom(III)-oxid wird aufgrund seiner Härte in Schleifmitteln eingesetzt. In vielen organischen Reaktionen dient es als Katalysator.
Unter dem Namen Chromoxidgrün ist es als olivgrünes Pigment erhältlich.[3] Es dient unter anderem als Emaillefarbe und zum Glasfärben.[11]
Die Reisezugwagen der Deutschen Bundesbahn und der Deutschen Reichsbahn waren mit Lacken angestrichen, die Chromoxidgrün enthalten (siehe auch Kölner Brückengrün).
Das Pigment Chromoxidgrün ist nicht mit dem giftigen Chromgrün zu verwechseln, einer Mischung aus Chromgelb und Berliner Blau.
Nachweis
BearbeitenChromoxid kann durch Oxidation zum gelben Chromat nachgewiesen werden. Dazu wird die Probe z. B. zusammen mit Kaliumnitrat und Natriumhydroxid eingeschmolzen (Oxidationsschmelze):
Risikobewertung
BearbeitenChrom(III)-oxid wurde 2018 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Chrom(III)-oxid waren die Besorgnisse bezüglich hoher (aggregierter) Tonnage sowie der möglichen Gefahren durch reproduktionstoxische und sensibilisierende Eigenschaften. Die Neubewertung fand ab 2019 statt und wurde von Frankreich durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[12][13]
Einzelnachweise
Bearbeiten- ↑ Eintrag zu CI 77288 in der CosIng-Datenbank der EU-Kommission, abgerufen am 19. September 2021.
- ↑ a b c d e f Eintrag zu Chrom(III)-oxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 21. Dezember 2019. (JavaScript erforderlich)
- ↑ a b c Eintrag zu Chromoxide. In: Römpp Online. Georg Thieme Verlag, abgerufen am 13. Juni 2014.
- ↑ a b Chromoxid 24. (pdf) Carl Jäger, 13. September 2016, abgerufen am 21. Dezember 2019.
- ↑ K. Dohnke: Die Lack-Story: 100 Jahre Farbigkeit zwischen Schutz, Schönheit und Umwelt. Dölling und Galitz, Hamburg 2000, ISBN 3-933374-64-2, S. 143.
- ↑ 44200 Chromoxidgrün. (PDF; 866 kB) Kremer Pigmente, November 2017, abgerufen am 18. Juli 2023.
- ↑ P. S. Robbert, H. Geisler, C. A. Ventrice, J. van Ek, S. Chaturvedi, J. A. Rodriguez, M. Kuhn, U. Diebold: Novel electronic and magnetic properties of ultrathin chromium oxide films grown on Pt(111). In: Journal of Vacuum Science & Technology A: Vacuum, Surfaces, and Films. Band 16, Nr. 3, 1. Mai 1998, S. 990–995, doi:10.1116/1.581283.
- ↑ Zhishan Mi, Li Chen, Changmin Shi, Yuan Ma, Dongchao Wang, Xiaolong Li, Hongmei Liu, Lijie Qiao: The effects of strain and vacancy defects on the electronic structure of Cr2O3. In: Computational Materials Science. Band 144, März 2018, S. 64–69, doi:10.1016/j.commatsci.2017.12.012.
- ↑ Jarnail Singh, Vikram Verma, Rajesh Kumar, Ravi Kumar: Structural, optical and electrical characterization of epitaxial Cr 2 O 3 thin film deposited by PLD. In: Materials Research Express. Band 6, Nr. 10, 7. August 2019, S. 106406, doi:10.1088/2053-1591/ab3543.
- ↑ François Lebreau, Mazharul M. Islam, Boubakar Diawara, Philippe Marcus: Structural, Magnetic, Electronic, Defect, and Diffusion Properties of Cr 2 O 3 : A DFT+ U Study. In: The Journal of Physical Chemistry C. Band 118, Nr. 31, 7. August 2014, S. 18133–18145, doi:10.1021/jp5039943.
- ↑ M. Binnewies et alii: Allgemeine und Anorganische Chemie. 2. Auflage. Spektrum, 2010, ISBN 3-8274-2533-6, S. 677.
- ↑ Europäische Chemikalienagentur (ECHA): Substance Evaluation Conclusion and Evaluation Report.
- ↑ Community Rolling Action Plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Chromium (III) oxide, abgerufen am 28. November 2023.