Eisen(II)-fluorid ist eine chemische Verbindung aus den Gruppen der Eisenverbindungen und der Fluoride.
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| _ Fe2+ _ F− | ||||||||||
| Allgemeines | ||||||||||
| Name | Eisen(II)-fluorid | |||||||||
| Andere Namen |
Eisendifluorid | |||||||||
| Verhältnisformel | FeF2 | |||||||||
| Kurzbeschreibung | ||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 93,84 g·mol−1 | |||||||||
| Aggregatzustand |
fest[2] | |||||||||
| Dichte | ||||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Gewinnung und Darstellung
BearbeitenEisen(II)-fluorid kann durch Reaktion von Eisen(II)-chlorid mit Fluorwasserstoff gewonnen werden.[3]
Das auf diese Weise hergestellte Produkt ist amorph. Um es kristallin zu erhalten, muss es auf 1000 °C erhitzt werden. Zusätzlich erhält man rein weißes Eisen(II)-fluorid nur, wenn völlig wasserfrei gearbeitet wird. Sonst färbt sich die Verbindung beim Rekristallisationsprozess grau-braun.[3]
Eigenschaften
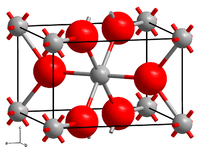
BearbeitenEisen(II)-fluorid ist in reinem Zustand ein weißer Feststoff, welcher in Wasser wenig löslich ist.[3] Es besitzt eine Kristallstruktur vom Rutil-Typ, Raumgruppe P42/mnm (Raumgruppen-Nr. 136), Gitterparameter a = 4,695 Å, c = 3,310 Å.[3][4]
Verwendung
BearbeitenEisen(II)-fluorid wird als Ausgangsstoff zur Herstellung weiterer Eisen(II)-Verbindungen verwendet.[5] Ferner wird es in der organischen Chemie als Katalysator für Fluorierungen verwendet.[6]
Einzelnachweise
Bearbeiten- ↑ a b c d David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. CRC Press, 2009, ISBN 978-1-4200-9084-0.
- ↑ a b c d e f Eintrag zu Eisen(II)-fluorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- ↑ a b c d e f Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 274.
- ↑ W.H. Baur, A.A. Khan: Rutile-type compounds. IV. SiO2, GeO2 and a comparison with other rutile-type structures. In: Acta Crystallographica, B27, 1971, S. 2133–2139, doi:10.1107/S0567740871005466.
- ↑ Catherine E. Housecroft, A. G. Sharpe: Inorganic chemistry. Prentice Hall, 2004, ISBN 978-0-13-039913-7 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Egon Wildermuth, Hans Stark, Gabriele Friedrich, Franz Ludwig Ebenhöch, Brigitte Kühborth, Jack Silver, Rafael Rituper: Iron Compounds. In: Ullmann’s Encyclopedia of Industrial Chemistry. 2000, doi:10.1002/14356007.a14_591.
