Hexafluoridokieselsäure ist eine chemische Verbindung, die nur in wässriger Lösung bekannt ist und stark sauer reagiert. Beim Versuch der vollständigen Entwässerung zersetzt sie sich zu Flusssäure und Siliciumtetrafluorid. Sie lässt sich als Dihydrat isolieren, das bei 60 °C unter Zersetzung schmilzt.[4] Die Salze der Hexafluoridokieselsäure (z. B. Magnesiumhexafluoridosilicat Mg[SiF6], Kaliumhexafluoridosilicat K2[SiF6], Natriumhexafluoridosilicat Na2[SiF6] oder Zinkhexafluoridosilicat Zn[SiF6]) werden Hexafluoridosilicate genannt.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
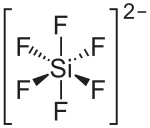
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Hexafluoridokieselsäure | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | H2[SiF6] | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 144,09 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||
| Dichte |
1,38 g·cm−3 (35proz. Lösung)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
110 °C (Zersetzung)[1] | |||||||||||||||
| Löslichkeit |
mischbar mit Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Gewinnung und Darstellung
BearbeitenHexafluoridokieselsäure entsteht bei Reaktion von Flusssäure mit Siliciumdioxid (Quarz, Sand, …)
oder durch Versetzen von Wasser mit Siliciumtetrafluorid.[5]
Es entsteht auch als Nebenprodukt beim Aufschluss (der Reaktion zur Herstellung von Phosphorsäure) von Fluorapatit mit Schwefelsäure, wobei Flusssäure entsteht, welche mit den im Fluorapatit in unterschiedlicher Menge als Beimischung enthaltenen Silikaten reagiert. Da die Hexafluoridokieselsäure vom Phosphor getrennt werden muss, hat sie als billiges Koppelprodukt verschiedene Anwendungen gefunden.
Eigenschaften
BearbeitenHexafluoridokieselsäure ist eine farblose Flüssigkeit, die in wasserfreiem Zustand bei Raumtemperatur bereits zu etwa 50 % in Siliciumtetrafluorid und Fluorwasserstoff gespalten ist. Unzersetzt destillierbar ist sie nur als 13,3%ige wässrige Lösung.[5] Das Hexafluoridosilikatanion SiF62− ist im Gegensatz zu den anderen Hexahalogenidosilikaten hydrolysestabil.
Verwendung
BearbeitenHexafluoridokieselsäure wird als Desinfektions- bzw. Konservierungsmittel von Holzmasten und Gerbebrühen, zur Reinigung von Kupfer- und Messing-Kesseln in Bierbrauereien, beim Säurepolieren von Kristallglas[6] und zur Herstellung von Metalloxid-Filmen verwendet. Weiterhin dient sie als Reagenz bei organischen Synthesen zum Aufspalten von Si–O-Bindungen bei Silylethern. In den USA wird die Verbindung häufig zur Fluoridierung von Wasser (zwecks Kariesprophylaxe) verwendet. Die Säure und ihre Salze werden als Fluate zur Oberflächenbehandlung von Natur- und Kunststeinen (Fluatierung von Beton) eingesetzt, um die Oberfläche zu härten und wasserundurchlässiger zu machen.[7] Man bezeichnet sie deshalb auch als Steinkristallisatoren. Die Wirkung beruht auf der Bildung unlöslicher Fluoride (Calciumfluorid) aus löslichen Calciumverbindungen des Materials der Oberfläche, sowie von Siliciumdioxid durch Hydrolyse des SiF62--Anions.[8]
Siehe auch
Bearbeiten- Hexafluorphosphorsäure HPF6
- Tetrafluorborsäure HBF4
Einzelnachweise
Bearbeiten- ↑ a b c d e f g h Eintrag zu Hexafluorokieselsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ Eintrag zu Hexafluorosilicic acid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Datenblatt Fluorosilicic Acid bei Fisher Scientific, abgerufen am 13. Februar 2014 (PDF).
- ↑ Eintrag zu Fluorokieselsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. April 2014.
- ↑ a b G. Brauer (Hrsg.): Handbook of Preparative Inorganic Chemistry, 2nd ed., vol. 1, Academic Press 1963, S. 214–215.
- ↑ e-kunststoffhandel.de: Beschreibung von Gaswäschern für die Glasindustrie ( vom 24. August 2007 im Internet Archive).
- ↑ sorglosweb.de: Produktbeschreibung einer Hexafluorosilikatmischung ( vom 28. Februar 2014 im Internet Archive) (PDF; 93 kB); (Seite dauerhaft nicht mehr aufrufbar).
- ↑ Otto Hähnle (Hrsg.): Baustoff-Lexikon. Deutsche Verlags-Anstalt, Stuttgart 1961, S. 333.

