Eisen(II)-sulfat (auch Ferrosulfat, Grünsalz, Eisenvitriol, früher auch Grüner Galitzenstein und lateinisch Vitriolum viride[6]) ist ein zweiwertiges Eisensalz der Schwefelsäure. Der Name Grünsalz für Eisen(II)-sulfat-Heptahydrat (FeSO4 · 7 H2O) leitet sich von der grünlichen Farbe des kristallwasserhaltigen Salzes ab.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
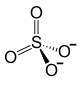
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Eisen(II)-sulfat | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | FeSO4 | |||||||||||||||||||||
| Kurzbeschreibung | ||||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse |
| |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
Leicht löslich in Wasser[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Vorkommen und Herstellung
BearbeitenDie Herstellung erfolgt durch Erhitzen von pulverisiertem Eisen in 20%iger Schwefelsäure:
Nach Beendigung der Wasserstoffentwicklung wird eingeengt und heiß abfiltriert.
Eisen(II)-sulfat kann auch kommerziell durch Oxidation von Pyrit gewonnen werden.
Bei der Produktion von Titandioxid mit dem Sulfatverfahren entsteht als Sekundärprodukt in großen Mengen ebenfalls Eisen(II)-sulfat. Die größten Mengen entstehen in Deutschland im Produktionsbetrieb in Nordenham von Kronos International. Ferner entsteht es auch beim Beizen von Eisenblechen.
In der Natur kommt Eisensulfat als Mineral Melanterit vor, es ist ein Verwitterungsprodukt von Pyrit. Es kommt dabei in verschiedenen Hydratformen vor, welche ebenfalls in der freien Natur auftreten.
- FeSO4·H2O (Mineral: Szomolnokit, relativ selten)
- FeSO4·4 H2O (Mineral: Rozenit, weiß, relativ verbreitet, Dehydratationsprodukt von Melanterit)
- FeSO4·5 H2O (Mineral: Siderotil, relativ selten)
- FeSO4·6 H2O (Mineral: Ferrohexahydrit, relativ selten)
- FeSO4·7 H2O (Mineral: Melanterit, blau, relativ verbreitet)
Eigenschaften
BearbeitenEisen(II)-sulfat kristallisiert aus wässrigen Lösungen als hellgrüne Kristalle, die 7 Mol Kristallwasser enthalten: FeSO4 · 7 H2O, daher auch der Name Eisen(II)-sulfat-heptahydrat. Nur in reinem Zustand ohne Kristallwasser (FeSO4) ist es hellblau. Die grünliche Färbung entsteht durch teilweise Oxidation zu Fe3+. Mit steigender Temperatur wird stufenweise Kristallwasser abgegeben. Kristallwasserabspaltung des Heptahydrats beginnt bei 60 °C, und ab 300 °C dann die des Hydrats.[2] An trockener Luft verwittern die Kristalle, diese Kristallwasserabspaltung gelingt vollständig bei längerem Erhitzen über 70 °C, dabei entsteht das Monohydrat als farbloses Pulver FeSO4 · H2O, welches bei starkem Erhitzen ab etwa 400 °C zu Eisen(III)-oxid, Schwefeldi- und Schwefeltrioxid zerfällt. Eisensulfat ist gut wasserlöslich, aber so gut wie unlöslich in Ethanol und Aceton. Die wässrige Lösung von Eisen(II)-sulfat reagiert sauer.[2] Die Lösung ist allerdings unbeständig, wobei durch Oxidation mit Luftsauerstoff teilweise basisches Eisen(III)-sulfat (Eisen(III)-hydroxysulfat) entsteht.[7]
Löslichkeit in Wasser[8]
| Salz | Tem- peratur |
Löslichkeit in H2O |
|---|---|---|
| wasserfrei | 20 °C | 256 g/kg |
| Monohydrat | 77 °C | 447 g/kg |
| 90 °C | 360 g/kg | |
| Heptahydrat | 0 °C | 157 g/kg |
| 10 °C | 205 g/kg | |
| 25 °C | 295 g/kg | |
| 40 °C | 399 g/kg | |
| 54 °C | 514 g/kg | |
Historische Verwendung
BearbeitenKupferwasser
BearbeitenKopperwasser, Kopperwater, Kupferwasser (lateinisch auch Vitriolum vulgare[9]) sind alte Bezeichnungen für unreines kristallwasserhaltiges farbiges (kupferhaltiges) Eisenvitriol.[10][11] Teilweise wurden im Mittelalter im gewerblichen Bereich auch Kupferwasser und Eisenvitriol gleichgesetzt; die Salze dienten neben Alaunen und anderen Kupfer-, Eisen-, Zink-, Chrom- und Zinnsalzen als Gerb- und Beizmittel.[12]
Kupferwasser wurde im Kupfer-Bergbau gewonnen und durch Hansehandel in Fässern verschifft. Im Jahr 1501 gehörte gemäß der Schrift „Summarische Extrakt und beschreybung der Khauf-Handels und Schefleuth im Lands Bayrn“ Kupferwasser zu den Gütern, die auf der Loisach verzollt wurden.[13]
Kupferhaltiger Eisenvitriol wurde als Chalcitis usta bezeichnet.[14]
Eisengallustinte
BearbeitenPerser, Meder, Assyrer und Hebräer schrieben auf ungegerbte Häute mit Tusche aus Ruß und Öl, die leicht abreib- oder abwaschbar war; etwa seit dem 3. Jahrhundert v. Chr. wurde Eisengallustinte, eine aus Eisen(II)-sulfat, Galläpfeln, Wasser und Gummi arabicum hergestellte Tinte, als dokumentenechte schwarze Tinte zum Schreiben auf Pergament und später Papier gebräuchlich.[15]
Heilmittel
BearbeitenEisensulfat findet sich in der Rezeptur bekannter Heilmittel des Mittelalters wie beispielsweise des Theriaks, das aus über 60 Bestandteilen (pflanzliche Auszüge, Opium, Gewürze, Schlangenfleisch und andere) bestand.
Sicherheitshinweise
BearbeitenEisen(II)-sulfat wirkt bei Kontakt akut reizend bis ätzend auf Haut und die Schleimhäute. Das Sulfat kann sowohl über Hautkontakt, als auch oral und über die Atemwege resorbiert werden. Eine orale Aufnahme relevanter Mengen über etwa 20 mg/kg Körpergewicht kann akut zu einer Schädigung des Magen-Darm-Trakts, der Leber und des Herz-Kreislaufsystems führen. Bei hohen Dosen ab 180–300 mg/kg sind Azidosen mit Todesfolge möglich. Bei chronischer Exposition kann eine Akkumulation mit Gewebeschädigungen an inneren Organen auftreten.[2]
Bei Kindern führte eine orale Aufnahme von 390 mg/kg (1964) zu Appetitlosigkeit und Schläfrigkeit mit Todesfolge (LDLo)[4]; in einem Vergiftungsfall von 1982 wurde eine orale LDLo von 699 mg/kg ermittelt.[16] Für Tiere liegen die oralen LD50-Werte bei 319 mg/kg (Ratte)[4], 600 mg/kg (Hund)[17] und 680 mg Eisensulfat pro kg Körpergewicht (Maus).[5]
Ab 400 °C zersetzt sich Eisen(II)-sulfat unter Entstehung teilweise toxischer Produkte wie Schwefeldioxid und Schwefeltrioxid.[2]
Moderne Verwendung
Bearbeiten- Im Labor und in der Synthesechemie ist es ein wichtiger Ausgangsstoff zur Herstellung von weiteren Eisenverbindungen.
- Zur Entschwefelung:
- Bei langen Abwasserkanalstrecken und Abwasserdruckleitungen kommt es in den wärmeren Jahreszeiten immer wieder zu Geruchsproblemen. Ursache ist die Bildung von Schwefelwasserstoff. Die Bildung von Schwefelwasserstoff kann mit Eisen(II)-sulfat verhindert werden.
- Biogasanlagen haben ebenfalls mit der Bildung von Schwefelwasserstoff zu kämpfen. Hier wird Eisen(II)-sulfat zur Biogasentschwefelung eingesetzt.
- Es wird auch zur Kohleentschwefelung eingesetzt.
- In der analytischen Chemie werden Nitrate und Nitrite mit Eisensulfatlösung qualitativ nachgewiesen und zwar durch die so genannte Ringprobe, beim Unterschichten der eisensulfathaltigen Probelösung mit konzentrierter Schwefelsäure bildet sich an der Grenzfläche ein brauner Ring von Eisennitrososulfat. Die quantitative Titration mit Eisensulfat-Maßlösung wird wegen der Instabilität der Lösung bezüglich der Oxidation durch Luftsauerstoff nur selten angewendet.
- Als Neutralisator:
- Bei der Abwasserreinigung dient es als Fäll- und Flockungsmittel. Besonders große Kläranlagen verwenden häufig Eisen(II)-sulfat zur Phosphatelimination. Das liegt daran, dass die Aufbereitung einer dosierfähigen Eisen(II)-sulfat-Lösung einen aufwendigen Lösebunker benötigt. Kleinere Kläranlagen verwenden normalerweise bereits industriell hergestellte zwei- oder dreiwertige Lösungen, die aus einem Lagertank heraus dosiert werden können. Für die Herstellung der dreiwertigen Eisen(III)-chloridsulfat-Lösung dient als Rohstoff Eisen(II)-sulfat.
- In der Bauwirtschaft wird es bei Bedarf chromathaltigem Zement zur Reduktion des CrVI zu CrIII zugesetzt als Chromatreduzierer.
- Zum Schutz von Holz vor Bemoosung und Verpilzung im Außenbereich.
- Als Eisen- und Schwefelquelle:
- Im Düngemittelbereich wird getrocknetes Eisen(II)-sulfat dem Rasendünger beigemischt. Dies führt zur Bekämpfung von Moosen und Nacktschnecken.
- Auch Verwendung als Schutz von Holz vor Moos- und Pilzbildung im Außenbereich (mit Vergrauung des Holzes als Nebenwirkung).
- Zur Bekämpfung der Chlorose im Weinbau.
- Als Farbmittel:
- Früher wurde mit einem Gallapfelsud, (welcher Gallussäure enthält) unter Zugabe von Eisensulfat schwarze Eisengallustinte hergestellt. Diese verursacht auf lange Sicht jedoch Tintenfraß in den Pergamenten, da das Eisensulfat bei der Verwitterung Schwefelsäure freisetzt.
- Als Dünger:
- In der Landwirtschaft.
- Als Arzneistoff:
- Heutzutage wird Eisen(II)-sulfat als hochwirksames blutbildendes Mittel in Form von Filmtabletten eingesetzt.[18]
Weblinks
BearbeitenEinzelnachweise
Bearbeiten- ↑ Eintrag zu FERROUS SULFATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 21. März 2020.
- ↑ a b c d e f g h i j k l Eintrag zu Eisen(II)-sulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ Eintrag zu Iron sulphate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b c d R. A. Yeary, R. A. Benish, M. Finkelstein: Acute toxicity of drugs in newborn animals. In: The Journal of Pediatrics. 69, 1966, S. 663, doi:10.1016/S0022-3476(66)80061-6. PMID 5921346
- ↑ a b British Journal of Pharmacology and Chemotherapy. Band 24, 1965, S. 352. PMID 14320849
- ↑ Otto Zekert (Hrsg.): Dispensatorium pro pharmacopoeis Viennensibus in Austria 1570. Hrsg. vom österreichischen Apothekerverein und der Gesellschaft für Geschichte der Pharmazie. Deutscher Apotheker-Verlag Hans Hösel, Berlin 1938, S. 159.
- ↑ A. F. Holleman, E. Wiberg: Lehrbuch der Anorganischen Chemie. 57.–70. Auflage. Walter de Gruyter, Berlin 1964, S. 550.
- ↑ Atherton Seidell, William F. Linke: Solubilities of Inorganic and Organic Compounds. 2. Auflage. D. Van Nostrand Company, New York 1919, S. 343 (Online).
- ↑ Otto Zekert (Hrsg.): Dispensatorium pro pharmacopoeis Viennensibus in Austria 1570. Hrsg. vom österreichischen Apothekerverein und der Gesellschaft für Geschichte der Pharmazie. Deutscher Apotheker-Verlag Hans Hösel, Berlin 1938, S. 159.
- ↑ Brockhaus' Konversationslexikon: Kupferwasser – Kupolofen
- ↑ Vgl. auch Gundolf Keil: Randnotizen zum „Stockholmer Arzneibuch“. In: Studia neophilologica. Band 44, Nr. 2, 1972, S. 238–262, hier: S. 255 (zu kopperwater).
- ↑ Sabine Struckmeier: Die Textilfärberei vom Spätmittelalter bis zur Frühen Neuzeit (14.–16. Jahrhundert): Eine naturwissenschaftlich-technische Analyse deutschsprachiger Quellen. Waxmann Verlag, 2011, ISBN 978-3-8309-7527-4, S. 73 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Flößerei Josef Seitner: Floßfahrt auf Loisach und Isar ( vom 29. September 2007 im Internet Archive), abgerufen am 5. Juni 2013.
- ↑ Otto Zekert (Hrsg.): Dispensatorium pro pharmacopoeis Viennensibus in Austria 1570. Hrsg. vom österreichischen Apothekerverein und der Gesellschaft für Geschichte der Pharmazie. Deutscher Apotheker-Verlag Hans Hösel, Berlin 1938, S. 138 (Chalcitis: Erzstufe).
- ↑ Tilman Nagel, Niedersächsische Staats- und Universitätsbibliothek Göttingen (Hrsg.): Begegnungen mit Arabien. 250 Jahre Arabistik in Göttingen. Wallstein Verlag, Göttingen 1998, ISBN 3-89244-097-2, S. 54 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Journal of Forensic Sciences. Band 27, 1982, S. 955.
- ↑ Felix R. Althaus: Lehrbuch der Pharmakologie und Toxikologie für die Veterinärmedizin. Georg Thieme Verlag, 2007, ISBN 978-3-8304-1070-6, S. 215 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Apothekeninfo Beipackzettel Eisensulfat Lomapharm 100mg In: apotheken-umschau.de.
