Guanidiniumnitrat, das Guanidinsalz der Salpetersäure, ist ein durchsichtiger bis weißer, brandfördernder kristalliner Feststoff.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
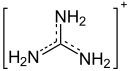 
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Guanidiniumnitrat | ||||||||||||||||||
| Andere Namen |
Guanidinsalpeter | ||||||||||||||||||
| Summenformel | CH6N4O3 | ||||||||||||||||||
| Kurzbeschreibung |
weißer geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 122,08 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,44 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
Zersetzung ab 250 °C[1] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Darstellung
BearbeitenGuanidiniumnitrat kann durch Eintragen von Salpetersäure in Guanidin- oder Guanidiniumcarbonatlösung dargestellt werden.[3] Die Reaktion kann stark exotherm verlaufen, daher muss die Temperatur ständig kontrolliert werden.
Eine andere Möglichkeit ist das gemeinsame Erhitzen von Ammoniumnitrat mit Harnstoff oder Dicyandiamid auf 210–230 °C.[4][5] Während das Reaktionsgemisch flüssig ist, muss es vor jeglicher Erschütterung geschützt werden und darf nicht umgerührt werden. Mechanische Störungen der Reaktion können zu einem rasanten Temperaturanstieg führen und unkontrollierbare Nebenreaktionen verursachen.
Eigenschaften
BearbeitenGuanidiniumnitrat bildet farblose Kristalle mit einem Schmelzpunkt von 214 °C. Es ist gut löslich in Wasser.[1] Guanidiniumnitrat ist ein explosionsfähiger, brandfördernder Stoff mit vergleichbaren Eigenschaften wie Ammoniumnitrat. Im Stahlhülsentest ergibt sich ein Grenzdurchmesser von 2,5 cm.[6] Die Bleiblockausbauchung beträgt 240 cm3/10 g.[6] Die Verbindung ist nicht schlag- bzw. reibempfindlich.[6] Sie kann aber durch eine Zündkapsel mit Booster zur Detonation gebracht werden. Mit einigen organischen Stoffen und manchen Metallpulvern bildet es auch hochexplosive Mischungen. Die Explosionswärme beträgt 2449 kJ·kg−1.[6]
Im Gegensatz zu anderen Salpetersäure-Salzen wie z. B. Harnstoffnitrat, reagiert Guanidiniumnitrat in wässriger Lösung nicht sauer, was auf den basischen Charakter des Guanidins zurückzuführen ist. Obwohl es sich um ein organisches Nitrat handelt, zählt es nicht zu den Salpetersäureestern, wie beispielsweise Glycerinnitrat oder Cellulosenitrat.
Von der Verbindung sind abhängig von der Temperatur mehrere Kristallstrukturen bekannt.[7]
Verwendung
BearbeitenWährend des Zweiten Weltkriegs wurde es aus Rohstoffmangel zusammen mit Ammoniumnitrat und Zusätzen von Hexogen in schmelzbaren Mischungen verwendet.[2]
Heutzutage dient es überwiegend als Ausgangsstoff für die Synthese von Nitroguanidin.[2] Darüber hinaus findet Guanidiniumnitrat auch als Bestandteil von Festtreibstoffen in Airbags Anwendung.[8][9]
Einzelnachweise
Bearbeiten- ↑ a b c d e f g h Eintrag zu Guanidiniumnitrat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ a b c Josef Köhler, Rudolf Meyer: Explosivstoffe. Wiley, 2009, ISBN 978-3-527-62583-3, S. 150 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Military Explosives. Headquarters, Department of the Army, S. 44 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Eintrag zu Guanidin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 17. Dezember 2019.
- ↑ K. G. Herring, L. E. Toombs, R. S. Stuart, George F Wright: Improved Preparation of Guanidine Nitrate. In: Industrial & Engineering Chemistry. Band 38, Nr. 12, 1946, S. 1315–1319, doi:10.1021/ie50444a027.
- ↑ a b c d Köhler, J.; Meyer, R.; Homburg, A.: Explosivstoffe, zehnte, vollständig überarbeitete Auflage. Wiley-VCH, Weinheim 2008, ISBN 978-3-527-32009-7.
- ↑ A. Katrusiak, M. Szafrański: Guanidinium nitrate. In: Acta Crystallographica Section C: Crystal Structure Communications. Band 50, Nr. 7, 1994, S. 1161–1163, doi:10.1107/S0108270193012272.
- ↑ Thomas Güthner, Bernd Mertschenk, Bernd Schulz: Guanidine and Derivatives. In: Ullmann’s Encyclopedia of Industrial Chemistry. 2006, ISBN 978-3-527-30385-4, S. 180, doi:10.1002/14356007.
- ↑ Chemical Rocket Propulsion. Springer International Publishing, ISBN 978-3-319-27748-6, S. 963 (eingeschränkte Vorschau in der Google-Buchsuche).

