Isoprenalin
Isoprenalin oder Isoproterenol ist als Strukturisomer zu Orciprenalin ein synthetisches racemisches Noradrenalin-Derivat, das als Sympathomimetikum verwendet wird. Der Arzneistoff wurde 1943 von Boehringer Ingelheim patentiert.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
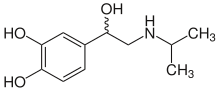
| ||||||||||||||||||||||
| Strukturformel ohne Stereochemie | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Isoprenalin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C11H17NO3 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 211,26 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert |
8,64[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Pharmakologie
BearbeitenIsoprenalin ist als Katecholamin eine adrenalinähnliche Substanz, die ausschließlich β-Adrenozeptoren aktiviert, während Noradrenalin eine hohe Affinität gegenüber α-Adrenozeptoren aufweist. Der N-Isopropyl-Substituent ist verantwortlich für diese Selektivität, gleichzeitig wird ein Optimum an β-Adrenozeptor-Affinität erreicht.
Es bewirkt die Erschlaffung der Bronchial- und Gefäßmuskulatur, sowie (bei Erwachsenen mit 1–5 µg/min[3] dosiert) Steigerung der Kontraktionskraft und Schlagfrequenz des Herzens sowie Blutdrucksenkung (während sich der systolische Blutdruck leicht erhöht, sinkt der diastolische Druck stark ab, was insgesamt eine Senkung des mittleren arteriellen Druckes zur Folge hat). Die ausgeprägte Wirkung auf das Herz erfolgt durch die Stimulation der β1-Adrenozeptoren, außerdem kommt es zur Freisetzung von Renin aus der Nierenrinde. Über die Rezeptoren wird das Enzym Adenylylcyclase aktiviert, welches die Synthese des cyclischen Adenosinmonophosphats (cAMP) katalysiert, was zu einer erhöhten Produktion desselben führt. Aufgrund der erhöhten cAMP-Konzentration kommt es zur Aktivierung des Enzyms Proteinkinase A, wodurch es zur Phosphorylierung spannungsabhängiger Calciumionenkanäle kommt. Diese sind für eine Zunahme des langsamen Ca2+-Einwärtsstroms während der Zell-Depolarisation verantwortlich. Die erhöhte Konzentration an Ca2+ resultiert in der erhöhten Herzschlagstärke. Der Herzschlag und die Erregungsleitung wird, vor allem im AV-Knoten, beschleunigt, da durch die Erhöhung des langsamen Einstroms an Na+- und Ca2+-Ionen die spontane diastolische Depolarisation in allen Herzabschnitten beschleunigt wird.
Zudem bremst Isoprenalin die antigeninduzierte Ausschüttung des Botenstoffs Histamin, wodurch die Vermittlung einer Anaphylaxie gebremst wird, und erhöht die Produktion von Laktaten. Des Weiteren hat es eine uterusrelaxierende Wirkung (Tokolyse).
Es ist mit nahezu allen gebräuchlichen Lösungen zur intravenösen Injektion kompatibel, mit Ausnahme von Natriumhydrogencarbonat. Bei der Behandlung des Bronchialasthma wird die Applikation lokal in Form eines Aerosols der systemischen Gabe vorgezogen, da der Wirkungseintritt so früher erfolgt und die systemische Wirkung, die Erregung von β1-Adrenozeptoren, geringer ausfällt.
Gegenanzeigen
BearbeitenDie Gabe von Isoprenalin ist bei Hyperthyreose, Koronar- und Arteriosklerose, sowie bei Herzinsuffizienz, tachykarden Rhythmusstörungen und arterieller Hypertonie kontraindiziert.
Stereochemie
BearbeitenIsoprenalin wird als 1:1-Gemisch (Racemat) der (R)- und (S)-Enantiomeren eingesetzt, obwohl die Bedeutung der Enantiomerenreinheit der synthetisch hergestellten Wirkstoffe zunehmend Beachtung eingeräumt wird, denn die beiden Enantiomeren eines chiralen Arzneistoffes zeigen fast immer eine unterschiedliche Pharmakologie und Pharmakokinetik. Das wurde früher aus Unkenntnis über stereochemische Zusammenhänge oft ignoriert.[4] Aus grundsätzlichen Überlegungen wäre eine Verwendung des besser bzw. nebenwirkungsärmer wirksamen Enantiomers zu bevorzugen. Die (R)- und die (S)-Isomere von Isoprenalin binden signifikant unterschiedlich an humane Serumproteine.[5]
Arzneimittelmarkt
BearbeitenFrüher vertrieb C. H. Boehringer Sohn (Ingelheim am Rhein) ein Aludrin-Elixir zum Lösen von Husten bei Bronchitis.[6] In Deutschland ist ein Fertigarzneimittel mit diesem Wirkstoff verfügbar.[7]
Literatur
Bearbeiten- Reinhard Larsen: Anästhesie und Intensivmedizin in Herz-, Thorax- und Gefäßchirurgie. (1. Auflage 1986) 5. Auflage. Springer, Berlin / Heidelberg / New York u. a. 1999, ISBN 3-540-65024-5, S. 46–47.
Einzelnachweise
Bearbeiten- ↑ a b Eintrag zu Isoprenalin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Dezember 2014.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Reinhard Larsen: Anästhesie und Intensivmedizin in Herz-, Thorax- und Gefäßchirurgie. (1. Auflage 1986) 5. Auflage. Springer, Berlin/Heidelberg/New York u. a. 1999, ISBN 3-540-65024-5, S. 44–47 und 76.
- ↑ E. J. Ariëns, Stereochemistry, a basis for sophisticated nonsense in pharmacokinetics and clinical pharmacology, European Journal of Clinical Pharmacology 26 (1984) 663-668, doi:10.1007/BF00541922.
- ↑ G. Sager, D. Sandnes, A. Bessesen und S. Jacobsen: Andrenergic ligand binding in human serum, Biochemical Pharmacology 34 (1985) 2812.
- ↑ Münchener Medizinische Wochenschrift. Band 95, Nr. 1, 2. Januar 1953, S. XLVII.
- ↑ Arzneimittelinformationssystem des Bundes – abgerufen am 15. Dezember 2024.