Kaliumchromat ist ein Kaliumsalz der Chromsäure (H2CrO4) mit der Summenformel K2CrO4. Es ist ein nicht brennbarer, zitronengelber, giftiger und umweltgefährlicher Feststoff. Das Salz ist ein starkes Oxidationsmittel und wirkt ätzend auf Haut und Schleimhäute.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| _ K+ _ Cr6+ _ O2− | ||||||||||||||||
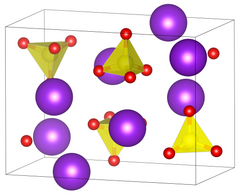
| Kristallsystem |
orthorhombisch | |||||||||||||||
| Raumgruppe |
Pnam (Nr. 62, Stellung 6) | |||||||||||||||
| Gitterparameter |
a = 7,663 Å, b = 10,388 Å, c = 5,922 Å[1] | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Kaliumchromat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | K2CrO4 | |||||||||||||||
| Kurzbeschreibung |
zitronengelber, kristalliner Feststoff[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 194,19 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
1000 °C[2] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: krebserzeugend, erbgutverändernd, fortpflanzungsgefährdend (CMR)[5]; zulassungspflichtig[6] | |||||||||||||||
| MAK |
| |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Gewinnung und Darstellung
BearbeitenDurch die Reaktion von Kaliumcarbonat und Kaliumdichromat wird Kaliumchromat hergestellt.
Eigenschaften
BearbeitenWasserfreies Kaliumchromat bildet zitronengelbe, prismenförmige Kristalle (orthorhombisch, Raumgruppe Pnam (Raumgruppen-Nr. 62, Stellung 6), Gitterparameter a = 7,663 Å, b = 10,388 Å, c = 5,92 Å[1]), welche sich oberhalb von 670 °C in eine rote hexagonale α-Modifikation umwandeln.
Bei Berührung mit brennbaren Stoffen ist das Salz feuergefährlich.
Verwendung
BearbeitenKaliumchromat wurde fast vollständig durch das preiswertere Natriumchromat ersetzt und wird nur noch für sehr spezifische Anwendungen, wie beispielsweise in der Analogfotografie oder als Indikator bei der Titration von Natriumchlorid nach Mohr verwendet (DAB7).
Nachweis
BearbeitenDas leichtlösliche Chromat-Anion (CrO42−) lässt sich in wässriger Lösung mit Metallkationen wie Ag+, Ba2+, Pb2+ und Hg22+ als, je nach Kation gelber, roter oder braunroter, Niederschlag ausfällen:
Es ist dabei zu beachten, dass in sehr sauren Lösungen das Chromat-Dichromat-Gleichgewicht zunehmend zum Dichromat verschoben ist. Daneben kann der Nachweis auch durch Reduktion des Chromat-Anions zu Cr3+ erfolgen, welche einen Farbumschlag von Gelb zu grün verursacht. Diese Reaktion dient auch zur halbquantitativen Bestimmung von Ethanol.
Sicherheitshinweise und gesetzliche Regelungen
BearbeitenKaliumchromat ist giftig und umweltgefährlich und führt zu Reizung und Schädigung von Haut und Schleimhäuten. Es schädigt Nieren, Blut und Leber und verursacht an verletzten Hautstellen schlecht heilende Wunden. Kaliumchromat wurde im Juni 2010 aufgrund seiner Einstufung als krebserzeugend (Carc. 1B) und mutagen (Muta. 1B) in die Kandidatenliste der besonders besorgniserregenden Stoffe (Substance of very high concern, SVHC) aufgenommen.[5] Im April 2013 wurde Kaliumchromat danach in das Verzeichnis der zulassungspflichtigen Stoffe mit dem Ablauftermin für die Verwendung in der EU zum 21. September 2017 aufgenommen.[6][8] Als Chrom(VI)-Verbindung unterliegt Kaliumchromat außerdem den Beschränkungen im Anhang XVII, Nummer 47 und 72 der REACH-Verordnung (in Deutschland umgesetzt durch die Chemikalien-Verbotsverordnung).[9]
Weblinks
BearbeitenEinzelnachweise
Bearbeiten- ↑ a b John A. McGinnety: Redetermination of the structures of potassium sulphate and potassium chromate: the effect of electrostatic crystal forces upon observed bond lengths. In: Acta Crystallographica. Band 28, 1972, S. 2845–2852, doi:10.1107/S0567740872007022.
- ↑ a b c d e f g h Eintrag zu Kaliumchromat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Januar 2019. (JavaScript erforderlich)
- ↑ Eintrag zu Kaliumchromat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juli 2014.
- ↑ Eintrag zu Potassium chromate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 14. Juli 2014.
- ↑ a b Eintrag im Verzeichnis der zulassungspflichtigen Stoffe der Europäischen Chemikalienagentur, abgerufen am 14. Juli 2014.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach Chrom(VI)-Verbindungen), abgerufen am 27. Oktober 2015.
- ↑ Verordnung (EU) Nr. 348/2013
- ↑ ECHA: Liste der beschränkten Stoffe – Anhang XVII der REACH-Verordnung, abgerufen am 5. September 2020.


