Phenylendiamine
| Phenylendiamine | ||||||||
| Name | o-Phenylendiamin | m-Phenylendiamin | p-Phenylendiamin | |||||
| Andere Namen | 1,2-Diaminobenzol |
1,3-Diaminobenzol |
1,4-Diaminobenzol, C.I. 76060 | |||||
| Strukturformel | 
|
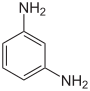
|
||||||
| CAS-Nummer | 95-54-5 | 108-45-2 | 106-50-3 | |||||
| ECHA-InfoCard | 100.002.210 | 100.003.259 | 100.003.096 | |||||
| PubChem | 7243 | 7935 | 7814 | |||||
| Summenformel | C6H8N2 | |||||||
| Molare Masse | 108,14 g·mol−1 | |||||||
| Aggregatzustand | fest | |||||||
| Kurzbeschreibung | farblose bis schwach rote Kristalle | |||||||
| Schmelzpunkt | 102,1 °C[1] | 63 °C[2] | 140 °C[3] | |||||
| Siedepunkt | 257 °C[1] | 284 °C[2] | 267 °C[3] | |||||
| pKs1-Wert[4] (der konjugierten Säure BH+) |
4,74 | 4,98 | 6,2 | |||||
| pKs2-Wert[4] (der konjugierten Säure BH+) |
0,6 | 2,41 | 2,67 | |||||
| Löslichkeit | 54 g·l−1 (20 °C)[1] | 429 g·l−1 (20 °C)[2] | 40 g·l−1 (24 °C)[3] | |||||
| mäßig bis gut löslich in Wasser, gut in organischen Lösungsmitteln | ||||||||
| GHS- Kennzeichnung |
|
| ||||||
| H- und P-Sätze | 301‐312+332‐317 319‐341‐351‐410 |
301+311+331‐317 319‐341‐410 |
301‐311‐331 319‐317‐410 | |||||
| keine EUH-Sätze | keine EUH-Sätze | keine EUH-Sätze | ||||||
| 273‐280‐302+352 305+351+338‐308+310 |
261‐273‐280‐301+310 305+351+338‐311 |
280‐273‐304+340‐302+352 305+351+338‐309+310 | ||||||
| MAK | Schweiz: 0,1 mg·m−3 (gemessen als einatembarer Staub)[5] | |||||||
| Toxizität | 720–1600 mg·kg−1 (LD50, Ratte, oral)[6] |
280 mg·kg−1 (LD50, Ratte, oral)[2] |
80 mg·kg−1 (LD50, Kaninchen, transdermal)[3] | |||||
Die Phenylendiamine (auch Diaminobenzole; Abk. PPD oder PDA) sind chemische Verbindungen aus der Gruppe der aromatischen Amine und wichtige Ausgangsstoffe für viele organische Verbindungen. Sie bestehen aus einem Benzolring mit zwei Aminogruppen (–NH2). Durch unterschiedliche Anordnung dieser Gruppen ergeben sich drei Konstitutionsisomere: 1,2-Phenylendiamin (ortho-Phenylendiamin), 1,3-Phenylendiamin (meta-Phenylendiamin) und 1,4-Phenylendiamin (para-Phenylendiamin).
Gewinnung und Darstellung
BearbeitenDie Phenylendiamine werden durch Reduktion der Nitroaniline mit Wasserstoff in Toluol als Lösungsmittel in Gegenwart eines Katalysators hergestellt und durch Destillation gereinigt. Reduktion von m-Dinitrobenzols mit Fe/HCl führt zu m-Phenylendiamin.[7]
Eigenschaften
BearbeitenDie Phenylendiamine bilden farblose bis schwach rote Kristalle, die an der Luft schnell oxidieren und sich dabei braun färben (o-Phenylendiamin: Bildung von o-Chinondiimin und weiter 2,3-Diaminophenazin). Daher werden häufig die stabilen Dihydrochloride der Verbindungen eingesetzt. o-Phenylendiamin kondensiert mit Ketonen und Aldehyden zu Schiff’schen Basen. Diese Reaktion erlaubt die Synthese substituierter Benzimidazole. Chinoxalindion kann durch Kondensation von o-Phenylendiamin mit Dimethyloxalat hergestellt werden.
Die Phenylendiamine sind kristalline Feststoffe. Ihre Schmelzpunkte unterscheiden sich deutlich. p-Phenylendiamin, das die höchste Symmetrie aufweist, besitzt den höchsten Schmelzpunkt.
Wasser ist als Lösungsmittel wenig geeignet. In vielen organischen Lösungsmitteln lösen sie sich dagegen gut.
Verwendung
Bearbeiteno-Phenylendiamin wird als Ausgangsstoff oder Zwischenprodukt für die Synthese heterocyclischer Verbindungen, insbesondere von Benzotriazol und Phenazin verwendet. Weiterhin wird o-Phenylendiamin verwendet bei der Herstellung
- von Benzotriazolen, die zur Herstellung von Kunststoffen und Photochemikalien, sowie als Korrosionsinhibitoren für Kupfer eingesetzt werden
- von Pflanzenschutzmitteln (z. B. als Benzimidazol, Phenylendiamin-Thioharnstoffcarbamat und Chinoxalin), Farbstoffen und Pigmenten
- von Benzimidazolderivaten für UV-Absorber bei Kosmetika, thermostabilen Polymeren und Pharmazeutika (bei veterinär verwendeten Viruziden und Anthelmintika)
- von 2-Mercaptobenzimidazol (Gummi-Antioxidans)
- von Haarfarben
- als Substrat im ELISA-Reagenz in biotechnologischen Laboratorien
Die Kunststoffindustrie produziert p-Phenylendiamin in großen Mengen für die Herstellung aromatischer Polyamide. Es ist dort zusammen mit Terephthalsäure wesentlicher Bestandteil der Aramide. p-Phenylendiamin fällt bei der Herstellung von Azofarbstoffen als Zwischenprodukt an. Die Synthesewege einiger Pharmazeutika und Photochemikalien verlaufen ebenso oft über diese Verbindung. Aufgrund seiner färbenden Eigenschaften finden p-Phenylendiamin und einige seiner Derivate (zum Beispiel 2-Nitro-p-phenylendiamin) in Kosmetika Verwendung (insbesondere für Haarfärbemittel, diese Verwendung wurde 1888 von Ernst Erdmann entdeckt). Vermutlich beruhen viele allergische Reaktionen bei Friseuren auf dem Kontakt mit diesem Farbstoff.[8][9] In einigen fotografischen Entwicklern ist die alkalische Lösung von p-Phenylendiamin aktive Komponente.
Sicherheitshinweise
Bearbeiteno-Phenylendiamin ist als krebserzeugend nach Kategorie 2 und als hautsensibilisierend eingestuft.[1] p-Phenylendiamin wird zu den Allergenen gezählt, da es bei Hautkontakt zu Reizungen und zur Sensibilisierung führen kann. Ferner wird diese Chemikalie in einigen Urlaubsorten auch zur Farbintensivierung und zum „Schwärzen“ von rotbraunen Henna-Tattoos verwendet.
o- und m-Phenylendiamin führen zur Bildung von Methämoglobin und dadurch zum Zerfall von roten Blutkörperchen, Leber- und Nierenschäden können die Folge sein. Die Substanz kann als Staub über die Atemwege, die Augen und über die Haut aufgenommen werden.[10]
Einzelnachweise
Bearbeiten- ↑ a b c d e Eintrag zu o-Phenylendiamin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 27. Dezember 2019. (JavaScript erforderlich)
- ↑ a b c d e Eintrag zu m-Phenylendiamin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 27. Dezember 2019. (JavaScript erforderlich)
- ↑ a b c d e Eintrag zu p-Phenylendiamin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 27. Dezember 2019. (JavaScript erforderlich)
- ↑ a b CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach Phenylendiamin), abgerufen am 25. November 2019.
- ↑ Datenblatt bei der Bundesagentur für Umweltschutz. ( vom 15. April 2014 im Internet Archive)
- ↑ Hans Beyer und Wolfgang Walter: Lehrbuch der Organischen Chemie, 19. Auflage, S. Hirzel Verlag, Stuttgart 1981, ISBN 3-7776-0356-2, S. 536, 542.
- ↑ BAUA: Begründung zu 2-Nitro-p-phenylendiamin in TRGS 907, Ausgabe: Dezember 2011, Stand: Mai 2011, abgerufen am 5. Dezember 2021
- ↑ WELT.de/AFP: Kosmetik: Allergisch vom Haarfärbemittel. In: Welt Online. 2007, abgerufen am 5. Dezember 2021.
- ↑ Eintrag zu Phenylendiamine. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. April 2015.


