Toluidine
| Toluidine | ||||||
| Name | o-Toluidin | m-Toluidin | p-Toluidin | |||
| Andere Namen | 2-Methylanilin, 1,2-Methylanilin, 1,2-Aminotoluol, o-Tolylamin |
3-Methylanilin, 1,3-Methylanilin, 1,3-Aminotoluol, m-Tolylamin |
4-Methylanilin, 1,4-Methylanilin, 1,4-Aminotoluol, p-Tolylamin | |||
| Strukturformel | 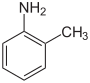
|

|
||||
| CAS-Nummer | 95-53-4 | 108-44-1 | 106-49-0 | |||
| PubChem | 7242 | 7934 | 7813 | |||
| ECHA-InfoCard | 100.002.209 | 100.003.258 | 100.003.095 | |||
| Summenformel | C7H9N | |||||
| Molare Masse | 107,16 g·mol−1 | |||||
| Aggregatzustand | flüssig | fest | ||||
| Kurzbeschreibung | farblos bis gelblich, verfärben sich an der Luft allmählich rotbraun | |||||
| Schmelzpunkt | −24,4 °C (alpha) −16,3 (beta) °C[1] |
−31 °C[2] | 45 °C[3] | |||
| Siedepunkt | 200 °C[1] | 203 °C[2] | 200 °C[3] | |||
| Dichte (20 °C) | 0,9984 g·cm−3[4] | 0,989 g·cm−3[4] | 0,9619 g·cm−3[4] | |||
| Brechungsindex | 1,5728[4] | 1,5670[4] | 1,5534[4] | |||
| pKs-Wert[5] (der konjugierten Säure BH+) |
4,44 | 4,70 | 5,08 | |||
| Löslichkeit | 15 g·l−1 (20 °C)[1] | 10 g·l−1 (20 °C)[2] | 7,5 g·l−1 (20 °C)[3] | |||
| wenig löslich in Wasser | ||||||
| Flammpunkt | 85 °C[4] | 86 °C[4] | 87 °C[4] | |||
| Zündtemperatur | 482 °C[4] | 482 °C[4] | 482 °C[4] | |||
| GHS- Kennzeichnung o[1], m[2], p[3] |
aus EU-Verordnung (EG) 1272/2008 (CLP)
| |||||
| H- und P-Sätze | 301+331‐319‐350‐400[1] | 301+311+331‐319‐373‐410[2] | 301‐311‐331‐317‐319‐351‐411[3] | |||
| keine EUH-Sätze | ||||||
| 201‐273‐304+340 305+351+338‐309+310[1] |
261‐273‐280‐301+310 305+351+338‐311[2] |
280‐302+350‐304+340 305+351+338‐301+310‐273[3] | ||||
| Toxikologie | 670 mg·kg−1 (LD50, Ratte, oral)[1] | 450 mg·kg−1 (LD50, Ratte, oral)[2] | 336 mg·kg−1 (LD50, Ratte, oral)[3] | |||
Die Toluidine (auch als Aminotoluole (Aminotoluene) bzw. Methylaniline bekannt) bilden eine Stoffgruppe in der Chemie und sind aromatische Verbindungen mit einer Methylgruppe (–CH3) und einer Aminogruppe (–NH2) als Substituenten am Benzolring. Durch unterschiedliche Anordnung der Substituenten (ortho, meta oder para) ergeben sich drei Konstitutionsisomere mit der Summenformel C7H9N. Sie sind in erster Linie als Vorprodukte bei der Herstellung von Farbstoffen und Pigmenten von Bedeutung.
Darstellung
BearbeitenDie Toluidine werden aus Nitrotoluolen (aus Toluol durch Nitrierung zugänglich) durch Reduktion hergestellt. Die Reduktion kann zum einen mit Eisen, Essigsäure und Salzsäure durchgeführt werden (Béchamp-Reduktion). Heute überwiegt die katalytische Hydrierung mit Raney-Nickel. Als Lösungsmittel werden hier oft niedere, aliphatische Alkohole (Methanol, Ethanol, 1-Propanol oder 2-Propanol) eingesetzt. Die Hydrierung findet in der Regel bei Drücken zwischen 3 bar und 20 bar H2-Druck (sog. Niederdruckhydrierung) oder bei 20 bis 50 bar (sog. Mitteldruckhydrierung) statt.
Eigenschaften
BearbeitenDie Toluidine besitzen nahezu gleich hohe Siedepunkte, unterscheiden sich dagegen deutlich in ihren Schmelzpunkten. Das p-Toluidin besitzt aufgrund seiner Symmetrie den höchsten Schmelzpunkt und ist ein Feststoff.
Die Toluidine sind schwache Basen, ihre (pKS-Werte) liegen in der gleichen Größenordnung wie Anilin (4,603[5]).
Die Dampfdruckfunktionen ergeben sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) wie folgt:
Reaktionen
BearbeitenDie Toluidine bilden mit starken anorganischen und organischen Säuren stabile Salze.
Die wichtigsten Reaktionen sind die
Das chemische Verhalten der Toluidine wird also (wie beim Anilin) durch den aromatischen Kern und die Aminogruppe bestimmt.
Verwendung
BearbeitenDie Toluidine hatten früher fast ausschließlich als Zwischenprodukte zur Herstellung von Farbstoffen und Pigmenten sehr große Bedeutung. Ortho-Toluidin darf nach reduktiver Spaltung von Azogruppen nicht von Textilien oder Ledererzeugnissen, die längere Zeit mit der menschlichen Haut direkt in Berührung kommen, freigesetzt werden (Anlage 1 der Bedarfsgegenständeverordnung). Mittlerweile werden auch einige Herbizide auf Basis dieser Verbindungen hergestellt. o- und p-Toluidin sind wichtige Ausgangsstoffe zur Herstellung von Chlortoluidinen und nitrierten Toluidinen. Diese dienen, neben den Toluidinsulfonsäuren, zur Herstellung von Pharmazeutika, Farbstoffen und Pigmenten.
Über eine Diazotierung (und anschließende „Verkochung“) können aus den Toluidinen die Kresole erhalten werden.
Literatur
Bearbeiten- J.S. Bowers, Jr.: Toluidines in Ullmann’s Encyclopedia of Industrial Chemistry, 2012 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, doi:10.1002/14356007.a27_159.
Siehe auch
Bearbeiten- N-Methylanilin C7H9N, anderes Isomer
- Dimethylaniline C8H11N, z. B. N,N-Dimethylanilin, N,2-Dimethylanilin - N,4-Dimethylanilin, Xylidine
- Trimethylaniline C9H13N, z. B. 2,4,6-Trimethylanilin
- Tetramethylaniline C10H15N, z. B. N,N,3,5-Tetramethylanilin
- Pentamethylaniline C11H17N, z. B. N,N,2,4,6-Pentamethylanilin
Einzelnachweise
Bearbeiten- ↑ a b c d e f g Eintrag zu o-Toluidin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 27. Dezember 2019. (JavaScript erforderlich)
- ↑ a b c d e f g Eintrag zu m-Toluidin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 27. Dezember 2019. (JavaScript erforderlich)
- ↑ a b c d e f g Eintrag zu p-Toluidin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 27. Dezember 2019. (JavaScript erforderlich)
- ↑ a b c d e f g h i j k l J.S. Bowers, Jr.: Toluidines in Ullmann’s Encyclopedia of Industrial Chemistry, 2012 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, doi:10.1002/14356007.a27_159.
- ↑ a b CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ a b R.R. Dreisbach, S.A. Shrader: Vapor Pressure-Temperature Data on Some Organic Compounds, in: Ind. Eng. Chem. 41 (1949), S. 2879–2880.
- ↑ D.R. Stull: Vapor Pressure of Pure Substances Organic Compounds, in: Ind. Eng. Chem. 39 (1947), S. 517–540.


