Milchsäuremethylester, auch als Methyllactat oder 2-Hydroxypropansäuremethylester bekannt, ist der Ester aus Methanol und Milchsäure. Die Verbindung wird überwiegend als Lösungsmittel verwendet. Die Dämpfe bilden ab einer Konzentration von 2,2 Vol-% explosionsfähige Gemische mit Luft.[2]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
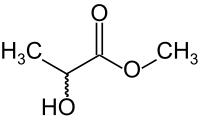
| |||||||||||||||||||
| Schlangenlinie = unbestimmte Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Milchsäuremethylester | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H8O3 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 104,11 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,09 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Siedepunkt |
144 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Brechungsindex |
1,4130[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten |
| ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Herstellung
BearbeitenMilchsäuremethylester kann durch Veresterung von Milchsäure mit Methanol hergestellt werden. Eine alternative Methode ist die Darstellung durch Reaktion von Milchsäure mit Diazomethan.[4]
Verwendung
BearbeitenDie farblose Flüssigkeit eignet sich als polares Lösungsmittel für Nitrocellulose und wird weiterhin als Lösungsmittel u. a. in Lacken verwendet.[2]
Einzelnachweise
Bearbeiten- ↑ a b c d e f Eintrag zu Methyllactat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ a b c Eintrag zu Milchsäureester. In: Römpp Online. Georg Thieme Verlag, abgerufen am 2. August 2018.
- ↑ Eintrag zu Methyl lactate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 2. August 2018. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Joachim Buddrus, Bernd Schmidt: Grundlagen der Organischen Chemie. 5. Auflage. De Gruyter, 2015, ISBN 978-3-11-033105-9, 18.4.5, S. 526 (eingeschränkte Vorschau in der Google-Buchsuche).

