Ammoniumcyanat, NH4OCN, ist eine chemische Verbindung und das Ammoniaksalz der Cyansäure.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
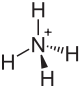 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Ammoniumcyanat | ||||||||||||
| Andere Namen |
Cyansaures Ammoniak | ||||||||||||
| Summenformel | NH4OCN | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 60,06 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Geschichte
BearbeitenDurch die Reaktion von Ammoniumcyanat zu Harnstoff gelang es 1828 Friedrich Wöhler erstmals, eine Verbindung sowohl aus anorganischen Vorgängerverbindungen darzustellen als auch aus tierischen bzw. menschlichen Produkten (Urin) zu gewinnen und so die Kluft zwischen organischer und anorganischer Chemie zu überwinden.[2]
Gewinnung und Darstellung
BearbeitenDie Herstellung von Ammoniumcyanat erfolgt durch die Neutralisation von Ammoniak mit Cyansäure:[3]
Eigenschaften
BearbeitenAmmoniumcyanat ist ein weißer Feststoff, der im tetragonalem Kristallsystem auskristallisiert. Es löst sich sehr gut in Wasser, teilweise in Ethanol und Chloroform und ist unlöslich in Benzol und Diethylether.[3] Oberhalb von 60 °C wandelt sich Ammoniumcyanat in Harnstoff um.
Einzelnachweise
Bearbeiten- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ William H. Brock: Viewegs Geschichte der Chemie. Vieweg, Braunschweig 1997, ISBN 3-540-67033-5, S. 129.
- ↑ a b Rodger B. Baird, Robert P. Pinnell, A. L. Allred, D. V. Stynes, D. L. Diemante: Ammonium Cyanate. In: Inorganic Syntheses. Band 13, 1972, S. 17–19, doi:10.1002/9780470132449.ch4.