Neugeborenengelbsucht
| Klassifikation nach ICD-10 | |
|---|---|
| P58.- | Neugeborenenikterus durch sonstige gesteigerte Hämolyse |
| P59.- | Neugeborenenikterus durch sonstige und nicht näher bezeichnete Ursachen |
| ICD-10 online (WHO-Version 2019) | |
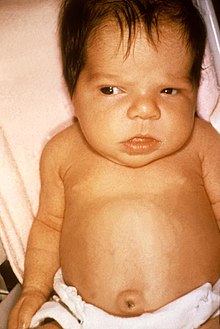
Der Begriff Neugeborenengelbsucht (Neugeborenenikterus, Gelbsucht der Neugeborenen; lat. Icterus neonatorum) beschreibt das Phänomen der Gelbfärbung von Haut, Skleren und anderen Geweben durch Einlagerung von Bilirubin, einem Abbauprodukt des roten Blutfarbstoffes Hämoglobin.
Etwa 60 % aller reifen gesunden Neugeborenen entwickeln in den ersten Lebenstagen eine mehr oder weniger stark ausgeprägte Gelbsucht (Ikterus),[1] die jedoch in den meisten Fällen physiologisch und vollkommen harmlos ist. Die Einlagerung erreicht in der Regel etwa am fünften Lebenstag ihr Maximum und sinkt dann allmählich ab.
Die Bilirubinkonzentration kann jedoch so stark ansteigen, dass Bilirubin über die Blut-Hirn-Schranke in das Gehirn eintritt und hier besonders empfindliche Strukturen dauerhaft schädigt. Man spricht dann von einem Kernikterus. Um dies zu vermeiden, werden Neugeborene mit stark erhöhten Bilirubinwerten vorbeugend mit einer Lichttherapie (Phototherapie) mit kurzwelligem Licht des sichtbaren Spektrums behandelt.
Ursache
BearbeitenBeim Abbau des roten Blutfarbstoffes Hämoglobin, genauer gesagt dessen eisenbindender Häm-Gruppe aus zerfallenden roten Blutkörperchen, den Erythrozyten, entsteht zunächst Biliverdin und aus diesem freies, sogenanntes unkonjugiertes Bilirubin. Dieses ist nicht wasser-, sondern fettlöslich. Damit es zur weiteren Verstoffwechselung und Ausscheidung in die Leber transportiert werden kann, wird es an das im Blut vorhandene Protein Albumin gebunden. In der Leberzelle wird das freie Bilirubin durch das Enzym Glukuronyltransferase mit Glukuronsäure verbunden (glukuronidiert) und dadurch in eine wasserlösliche Form umgewandelt (siehe Biotransformation). Es entsteht das sogenannte direkte, konjugierte Bilirubin. Dies kann nun mit der Gallenflüssigkeit ausgeschieden werden. Im Darm wird ausgeschiedenes konjugiertes Bilirubin zumindest teilweise wieder dekonjugiert und zurück in die Blutbahn aufgenommen (sogenannter enterohepatischer Kreislauf). Bei Neugeborenen ist die Lebensdauer der Erythrozyten auf etwa 70 Tage verkürzt, wodurch besonders viel von diesem Abbauprodukt anfällt. Außerdem ist durch eine Unreife der Leber die Glukuronyltransferase noch nicht in vollem Umfang aktiv. Diese Faktoren führen dazu, dass in den ersten Lebenstagen mehr Bilirubin neu gebildet wird als die Leber ausscheiden kann. Eine mögliche biologische Funktion der erhöhten Bilirubinkonzentration in den ersten Lebenstagen könnte darin begründet sein, dass das Bilirubin in der Lage ist, freie Sauerstoff-Radikale abzufangen. Dadurch kann es möglicherweise die Kinder vor Erkrankungen schützen, die durch oxidativen Stress begünstigt werden.[2][3]
Formen
BearbeitenIn der Kinderheilkunde werden vier Verlaufsformen unterschieden:[4]
- Physiologischer Neugeborenenikterus: Dieser beginnt zwischen dem 3. und 6. Lebenstag und bildet sich bis zum 10. Lebenstag zurück.
- Icterus praecox: Dieser tritt meistens aufgrund von Blutgruppenunverträglichkeit bereits am ersten Lebenstag auf.
- Icterus gravis: Dieser ist gekennzeichnet durch sehr hohe Bilirubinkonzentrationen von mehr als 20 mg/dl beim reifen Neugeborenen, Frühgeborene haben niedrigere Grenzen.
- Icterus prolongatus: Dieser besteht länger als zwei Wochen.
Risikofaktoren
BearbeitenAlle Zustände, die zu einem vermehrten Abbau von Hämoglobin führen, können eine Neugeborenengelbsucht begünstigen. Dazu gehören zum einen Blutergüsse, die beispielsweise während der Geburt (lat. sub partu) entstehen können, wie das Kephalhämatom oder die Geburtsgeschwulst (Caput succedaneum). Zum anderen kann ein verstärkter Zerfall von Erythrozyten (Hämolyse) bei Blutgruppenunverträglichkeiten zwischen Mutter und Kind zum vermehrten Anfall von Bilirubin führen. Die klassische Rhesus-Inkompatibilität (Mutter rh-negativ, Kind Rh-positiv) ist dabei aufgrund verbesserter Vorsorgemaßnahmen selten geworden. Aber eine Unverträglichkeit im Bereich der Blutgruppenmerkmale AB0 (Mutter Blutgruppe 0, Kind Blutgruppe A oder B) kann ebenfalls einen verstärkten Zerfall von roten Blutkörperchen zur Folge haben. Schließlich gibt es auch eine Reihe von angeborenen Erkrankungen, die mit einer Hämolyse einhergehen (hämolytische Anämien) wie die Kugelzellen-, die Sichelzellenanämie oder der Glucose-6-Phosphat-Dehydrogenase-Mangel. Die Frage, ob ein Geschwister als Neugeborenes schon einmal eine verstärkte Gelbsucht hatte, ist daher von besonderer Bedeutung. Auch eine verzögerte Entleerung des Darmes erhöht durch vermehrte Aufnahme des wieder gespaltenen Bilirubins die Gefahr einer verstärkten Gelbsucht in den ersten Lebenstagen.
Komplikationen
BearbeitenDer Neugeborenenikterus wäre eigentlich kein Problem, da er als häufiges Phänomen grundsätzlich normal oder physiologisch ist. Überschreitet die Menge des (unkonjugierten, fettlöslichen) Bilirubins aber einen Schwellenwert, kann es die Blut-Hirn-Schranke überwinden und aus der Blutbahn in das Gehirn eindringen. Dort lagert es sich in bestimmten Strukturen, den sogenannten Basalganglien, ab. Diese werden schließlich unter Umständen dauerhaft geschädigt, es tritt ein sogenannter Kernikterus ein. Die Höhe der gefährlichen Konzentration ist nicht exakt bekannt, sie liegt aber sicherlich weit jenseits einer Konzentration von 20 mg/dl (340 µmol/l). Für diese Komplikation besonders gefährdet sind Kinder, deren Blut-Hirn-Schranke aus anderen Gründen (noch) nicht vollständig funktioniert. Hierzu gehören alle Frühgeborenen, aber auch Termingeborene mit akuten Erkrankungen, die zu einer Beeinträchtigung der Blut-Hirn-Schranke führen. Dazu zählen beispielsweise schwerer Sauerstoffmangel unter der Geburt (Asphyxie), die dadurch oder durch andere Ursachen bedingte Übersäuerung des Körpers (Azidose), Unterzuckerung (Hypoglykämie), Mangel an Albumin (Hypalbuminämie), Schock oder bakterielle Infektionen (Sepsis).[5]
Diagnose
BearbeitenBei allen Neugeborenen, die eine sichtbare Gelbsucht entwickeln, soll spätestens 72 Stunden nach der Geburt eine Bestimmung des im Blut zirkulierenden Bilirubins erfolgen.[1] Dies kann bei der ohnehin für das Neugeborenenscreening notwendigen Blutentnahme geschehen. Weitere routinemäßige Bilirubin-Kontrollen können auch unblutig mit einer photometrischen Messung der Bilirubin-Konzentration in der Haut (sogenannte transkutane Messung mit einem Multispektralgerät) durchgeführt werden. Insbesondere bei vorzeitiger Gelbsucht (Icterus praecox) schon am ersten Lebenstag sollte zusätzlich eine gründliche Untersuchung durch einen Kinderarzt erfolgen, um sicherzustellen, dass keine zugrundeliegende komplizierende Erkrankung vorliegt.
Differentialdiagnose
BearbeitenAuch wenn der physiologische Neugeborenenikterus eine häufige Diagnose ist, müssen natürlich immer andere zugrundeliegende Erkrankungen ausgeschlossen werden. Zuallererst sollte eine Differenzierung des gelben Blutfarbstoffes in konjugiertes (direktes) und unkonjugiertes (indirektes) Bilirubin sicherstellen, dass nur das unkonjugierte Bilirubin betroffen ist. Andernfalls muss die Ursache der Gelbsucht einerseits in Erkrankungen der Leber selbst in Form von Infektionen oder angeborenen Stoffwechselerkrankungen gesucht werden. Andererseits kann eine Abflussstörung der Gallenflüssigkeit bei angeborenem Gallenwegsverschluss (Gallengangatresie) vorliegen. Auch wenn allein das indirekte Bilirubin erhöht ist, müssen angeborene Erkrankungen, die mit einem erhöhten Blutzerfall einhergehen, ausgeschlossen werden. Hierbei ist zwischen den immunologischen Ursachen bei Vorliegen einer Blutgruppenunverträglichkeit und erblichen Erkrankungen zu unterscheiden (siehe auch Abschnitt Risikofaktoren).
Therapie
BearbeitenAllgemeine Maßnahmen
BearbeitenAls unterstützende Maßnahmen kommen für sichtbar gelbe, aber noch nicht gefährdete Neugeborene eine zusätzliche Flüssigkeitsgabe und frühes häufiges Füttern in Frage. Dadurch soll die Darmtätigkeit angeregt und somit der enterohepatische Kreislauf unterbunden werden. Für diese Maßnahmen gibt es jedoch keinen wissenschaftlich gesicherten Wirkungsnachweis.
Phototherapie
BearbeitenBei allen Neugeborenen, deren Gelbsucht von den Fachgesellschaften festgelegte altersbezogene Schwellenwerte übersteigen, muss zur Vorbeugung eines Kernikterus rechtzeitig eine Behandlung durch Bestrahlung mit blauem Licht einer Wellenlänge von idealerweise 459 nm (Praxis: 450–475 nm) eingeleitet werden. Für ansonsten unauffällige Neugeborene mit einem Gestationsalter über 38+0 Wochen und einem Lebensalter von mindestens 72 Stunden liegt der Schwellenwert zurzeit bei 20 mg/dl (340 µmol/l).[1] Diese kurzwelligen Lichtstrahlen sind in der Lage, im unkonjugierten Bilirubin eine Doppelbindung zu zerstören. Das dadurch entstandene wasserlösliche Lumirubin kann ohne Glukuronidierung über die Galle und mit den Nieren über den Urin ausgeschieden werden.[5] Zur sogenannten Phototherapie stehen neben konventionellen Lampen oder Leuchtdioden, die über das Bett oder den Inkubator gestellt werden können, auch Blaulicht-Fluoreszenzröhren und fiberoptische Leuchtmatten, die das Kind von unten beleuchten, zur Verfügung. Je nach Verlauf wird die Therapie einen bis mehrere Tage lang, möglicherweise auch mit Unterbrechungen zwischen je zwei Mahlzeiten (intermittierende Therapie) angewendet.
Die Phototherapie ist auch mit Nebenwirkungen belastet, weshalb sie nicht unkritisch ohne tatsächliche Notwendigkeit eingesetzt werden sollte. Zum einen kann die Netzhaut des Auges (Retina) durch die recht energiereichen Lichtstrahlen geschädigt werden. Daher müssen die Augen der zu behandelnden Kinder durch entsprechende „Brillen“ abgedeckt werden. Es entstehen außerdem erhöhte Wasser- und Salzverluste über die Haut und es kann zu Entzündungen der Bindehäute der Augen (Konjunktivitis) und der Haut (Dermatitis) sowie zu Störungen der Wärmeregulation kommen. Nicht zuletzt bedeutet eine Phototherapie auch eine Trennung von Mutter und Kind. Epidemiologische Untersuchungen beschreiben eine schwache statistische Assoziation zwischen Phototherapie und dem späteren Auftreten von Hautveränderungen wie melanozytischen Naevi[6] oder Café-au-lait-Flecken[7] sowie zwischen Phototherapie und akuter myeloischer Leukämie.[8][9]
Austauschtransfusion
BearbeitenBei besonders schnell und stark ansteigendem Verlauf beispielsweise im Rahmen einer Rhesus-Inkompatibilität reicht die Phototherapie möglicherweise nicht aus, um genügend Bilirubin abzubauen. Bei Bilirubinwerten über 30 mg/dl sollte Blutaustauschtransfusion erfolgen.[10] Dabei wird dem Neugeborenen über ein großes Blutgefäß, meist die Nabelvene, solange das eigene Blut entzogen und durch eine andere Ader Blutkonserven der Blutgruppe 0 rh negativ transfundiert, bis das gesamte Blutvolumen einmal ausgetauscht ist. Dadurch soll der beschleunigte Zerfall des eigenen Blutes gestoppt und ein weiterer Anstieg der Bilirubinkonzentration in schädigende Bereiche verhindert werden.
Prognose
BearbeitenDie Prognose der Neugeborenengelbsucht ist – bei Therapie – insgesamt als sehr gut einzuschätzen. Eine amerikanische Studie hat 140 reife, sonst gesunde Neugeborenen mit Bilirubinwerten von 25 bis über 30 mg/dl (425 bis über 510 µmol/l) untersucht. Die Kinder wurden überwiegend mit Phototherapie, in fünf Fällen auch mit Austauschtransfusion behandelt. Gegenüber einer Vergleichsgruppe konnten die Autoren keine bleibenden neurologischen Beeinträchtigungen feststellen.[11]
Geschichte
BearbeitenObwohl es sich bei der Neugeborenengelbsucht um ein häufiges Phänomen handelt, das von Medizinern aller Epochen wahrgenommen worden sein muss, gibt es aus der Antike hierzu keine Aufzeichnungen. Erste Berichte stammen vermutlich von Morgagni aus dem frühen 18. Jahrhundert. Zumindest werden von Hervieux Beschreibungen von 15 gelben Neugeborenen zitiert. 1785 erhielt Jean Baptiste Thimotée Baumes einen Preis der Pariser Universität für seine Arbeit über die Behandlung der Gelbsucht der Neugeborenen. Er war der Auffassung, der Ikterus würde durch eine verzögerte Ausscheidung des Kindspech (Mekonium), wie der erste Stuhlgang der Neugeborenen genannt wird, verursacht. Als Therapie empfahl er folgerichtig Muttermilch, insbesondere Kolostrum. Damit hat er zu seiner Zeit einen pathophysiologischen Mechanismus erkannt, der sich mit heutigem Wissen durchaus deckt.
Der oben schon erwähnte Jacques François Édouard Hervieux verteidigte 1847 seine Dissertation De l’Ictère des Nouveau-nés (deutsche Übersetzung Über den Ikterus der Neugeborenen), die von den Prüfern mit der höchsten Note (très satisfait, „sehr zufriedenstellend“) bewertet wurde. Darin verwarf er die meisten Theorien seiner Vorgänger und präsentierte seine eigenen Beobachtungen an 45 Kindern, von denen 44 gestorben und von ihm obduziert worden waren. Dennoch muss er noch eine Reihe weiterer überlebender Kinder gesehen haben. Jedenfalls beschreibt er die Neugeborenengelbsucht schon als eigentlich physiologischen Zustand, der an und für sich nicht gefährlich sei und von alleine verschwinde. Auch der typische zeitliche Ablauf, das Fortschreiten vom Kopf zum Fußende, die Häufigkeit von annähernd zwei Dritteln aller Neugeborenen und die gute Prognose bei Fehlen von komplizierenden Begleiterkrankungen wurde von Hervieux schon in einer Weise erfasst, wie sie noch heute in einem Lehrbuch stehen könnte.
Der deutsche Pathologe Johannes Orth gilt als Erstbeschreiber des Kernikterus. Er veröffentlichte 1875 die Ergebnisse der Obduktion eines Kindes, das zwei Tage nach der Geburt mit einer ausgeprägten Gelbsucht ohne weitere offensichtliche Symptome verstarb. Er beschrieb eine intensive Gelbfärbung des gesamten Gehirns mit besonderer Betonung der Basalganglien und machte darauf aufmerksam, dass eine solche Gelbfärbung des Nervensystems bei Erwachsenen mit Gelbsucht fehlt. Der Begriff Kernikterus wurde dann aber erst 1904 von Georg Schmorl geprägt. Im Weiteren wurde er nicht nur für das pathologisch-anatomische Bild des Gehirns von mit Gelbsucht verstorbenen Kindern, sondern auch für das neurologische Krankheitsbild verwendet, an dem die Überlebenden einer schweren Neugeborenengelbsucht litten.[12]
Einzelnachweise
Bearbeiten- ↑ a b c M. Marcinkowski, C. Bührer: Hyperbilirubinämie – Diagnostik und Therapie bei reifen gesunden Neugeborenen. AWMF-Leitlinie. AWMF, Düsseldorf 2003; awmf.org
- ↑ D. A. Benaron, F. W.Bowen: Variation of initial serum bilirubin rise in newborn infants with type of illness. In: The Lancet, 1991, 338, S. 78–81; PMID 1676469
- ↑ T. Hegyi, E. Goldie, M. Hiatt, The protective role of bilirubin in oxygen-radical diseases of the preterm infant. In: J Perinatol, 1994, 14, S. 296–300; PMID 7965225
- ↑ Berthold Koletzko: Kinder- und Jugendmedizin.
- ↑ a b M. Berns: Hyperbilirubinämie beim reifen Neugeborenen – Interventionsgrenzen. In: Monatsschrift Kinderheilkunde, 2006; 154, S. 835–843.
- ↑ J. Oláh, E. Tóth-Molnár, L. Kemény, Z. Csoma: Long-term hazards of neonatal blue-light phototherapy. In: The British Journal of Dermatology. Band 169, Nr. 2, August 2013, ISSN 1365-2133, S. 243–249, doi:10.1111/bjd.12335, PMID 23521230.
- ↑ Kathrin Wintermeier, Martina von Poblotzki, Orsolya Genzel-Boroviczény, Sandra Vogel, Klaus Schotten: Neonatal blue light phototherapy increases café-au-lait macules in preschool children. In: European Journal of Pediatrics. Band 173, Nr. 11, November 2014, ISSN 1432-1076, S. 1519–1525, doi:10.1007/s00431-014-2349-8, PMID 24942237.
- ↑ S. Cnattingius, M. Zack, A. Ekbom, J. Gunnarskog, M. Linet: Prenatal and neonatal risk factors for childhood myeloid leukemia. In: Cancer Epidemiology, Biomarkers & Prevention: A Publication of the American Association for Cancer Research, Cosponsored by the American Society of Preventive Oncology. Band 4, Nr. 5, Juli 1995, ISSN 1055-9965, S. 441–445, PMID 7549797.
- ↑ Danise Podvin, Carrie M. Kuehn, Beth A. Mueller, Michelle Williams: Maternal and birth characteristics in relation to childhood leukaemia. In: Paediatric and Perinatal Epidemiology. Band 20, Nr. 4, Juli 2006, ISSN 0269-5022, S. 312–322, doi:10.1111/j.1365-3016.2006.00731.x, PMID 16879503.
- ↑ awmf.org
- ↑ T. B. Newman et al.: Outcomes among newborns with total serum bilirubin levels of 25 mg per deciliter or more. In: New England Journal of Medicine, 2006, 344, S. 1889–1900; PMID 16672700.
- ↑ T. W. R. Hansen: Pioneers in the Scientific Study of Neonatal Jaundice and Kernicterus. In: Pediatrics, 2000, 106; ISSN 0031-4005.