Polyphosphorsäuren sind chemische Verbindungen aus der Gruppe der Phosphorverbindungen. Es sind von der Orthophosphorsäure H3PO4 durch Dehydratisierung abgeleitete ketten- oder ringförmige Polymere, in denen die [PO4]-Tetraeder über Sauerstoffbrücken miteinander verknüpft sind.[2] Zur besseren Unterscheidung von den kettenförmigen Polyphosphorsäuren werden ringförmige Polyphosphorsäuren als Metapolyphosphorsäuren und Polyphosphorsäuren mit verzweigten Ketten als Ultraphosphorsäuren bezeichnet.[3] Die Verbindung kommt mit unterschiedlichen Gehalten an Diphosphorpentoxid P2O5 in den Handel. Die Angaben in der Box beziehen sich auf ein handelsübliches Produkt mit einem Diphosphorpentoxid-Gehalt von ca. 85 %.[1] Die Salze der Polyphosphorsäuren werden als Polyphosphate (systematisch: catena-Polyphosphate) bzw. Metapolyphosphate bezeichnet.[4]
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
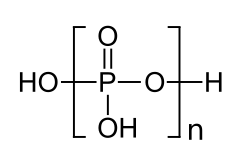
| |||||||
| Allgemeines | |||||||
| Name | Polyphosphorsäure, Diphosphorpentoxid-Gehalt von ca. 85 % | ||||||
| Andere Namen |
PPA | ||||||
| CAS-Nummer | 8017-16-1 | ||||||
| EG-Nummer | 232-417-0 | ||||||
| ECHA-InfoCard | |||||||
| Monomer | Orthophosphorsäure | ||||||
| Summenformel der Wiederholeinheit | HPO3 | ||||||
| Molare Masse der Wiederholeinheit | 79,97 g/mol | ||||||
| Art des Polymers |
Monomer | ||||||
| Kurzbeschreibung |
farb- und geruchlose Flüssigkeit[1] | ||||||
| Eigenschaften | |||||||
| Aggregatzustand |
flüssig[1] | ||||||
| Dichte |
2,06 g·cm−3[1] | ||||||
| Schmelzpunkt | |||||||
| Löslichkeit |
hydrolysiert in Wasser[1] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Gewinnung und Darstellung
BearbeitenKetten und ringförmige Polyphosphorsäuren bilden sich beim Erwärmen über 300 °C via Kondensationsreaktionen (Wasserabspaltung). Die einfachsten Vertreter sind Diphosphorsäure, auch als Pyrophosphorsäure bezeichnet, und Triphosphorsäure, die durch Kondensation von zwei beziehungsweise drei Orthophosphorsäuremolekülen im Drehrohrofen bei Temperaturen zwischen 400 und 600 °C entstehen. Je nach Zeitdauer der Wärmeeinwirkung und Temperatur kann der Kondensationsgrad n bis auf 10.000 anwachsen.[4]
Die Pyrophosphorsäure ist die einzige von den linearen Polyphosphorsäuren, die leicht in kristalliner Form erhalten werden kann. Sie besitzt einen theoretischen Diphosphorpentoxid-Gehalt von 79,8 %. Bringt man eine flüssige Säure mit dieser Konzentration zum Kristallisieren, erhält man Pyrophosphorsäure (Form I), die gewöhnliche Form (Schmelztemperatur 54,3 °C), als weißen Festkörper. Wird die kristalline Form I in einem abgeschlossenen Rohr mehrere Stunden auf 50 °C erhitzt, dann erfolgt eine Umwandlung in eine Form II (Schmelztemperatur 71,5 °C), die bei Raumtemperatur die stabile Form ist.[5]
Durch Zugabe von wenig Wasser zu Diphosphorpentoxid sind sie ebenfalls zugänglich.[6] Zum Beispiel erhält man Tetrametaphosphorsäure, wenn hexagonales P4O10 langsam in Eiswasser gegeben wird.[5] Außerdem entstehen Polyphosphorsäuren beim thermischen Zerfall der als Flammschutzmittel verwendeten Ammoniumphosphate.[6]
Die Salze der Metapolyphosphorsäuren können beispielsweise durch alkalische Hydrolyse von Phosphorpentoxid gewonnen werden.[4]
Eigenschaften
BearbeitenPolyphosphorsäuren sind je nach Polymerisationsgrad farblose, hochviskose bis glasartige Stoffe, deren Säurestärke mit zunehmender Kettenlänge zunimmt.[4] In allen Phosphorsäuren und Polyphosphaten teilen die aufbauenden PO4-Tetraeder miteinander nur die Ecken, nie Kanten oder gar Flächen. Die POP-Winkel besitzen Werte zwischen 120 und 180° (je nach dem Ausmaß der Bildung von dπpπ-Bindungen).[7]
Handelsübliche Polyphosphorsäure ist eine hygroskopische, viskose, farb- und geruchlose Flüssigkeit, die in Wasser hydrolysiert. Ihre wässrige Lösung reagiert stark sauer.[1]
Verwendung
BearbeitenPolyphosphorsäuren werden als Zwischenprodukt zur Herstellung abgeleiteter Verbindungen verwendet. Die Salze der Polyphosphorsäuren bilden mit Metallionen wasserlösliche Komplexverbindungen. So ist insbesondere das Pentanatriumtripolyphosphat kommerziell bedeutsam, das als Wasserenthärtungsmittel Verwendung findet.[4] Auch werden sie zur Herstellung von Ammoniumphosphaten eingesetzt.[8]
Einzelnachweise
Bearbeiten- ↑ a b c d e f g h i Eintrag zu Polyphosphorsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. Januar 2024. (JavaScript erforderlich)
- ↑ Lexikon der Chemie: Polyphosphorsäuren, abgerufen am 27. Mai 2022.
- ↑ Erwin Riedel, Christoph Janiak: Anorganische Chemie. De Gruyter, 2015, ISBN 978-3-11-038774-2 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c d e Josef K. Felixberger: Chemie für Einsteiger. Springer Berlin Heidelberg, 2017, ISBN 978-3-662-52821-1, S. 211 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b E. Schwarzmann: Hydroxide, Oxidhydrate und Oxide Neue Entwicklungen. Springer-Verlag, 2013, ISBN 978-3-642-87024-8, S. 55 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Chemgapedia: Polyphosphorsäure, abgerufen am 27. Mai 2022.
- ↑ A. F. Holleman, Wiberg Nils: Lehrbuch der anorganischen Chemie. De Gruyter, 2019, ISBN 978-3-11-083817-6, S. 660 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Martin Bertau, Peter Fröhlich, Michael Katzberg: Industrielle Anorganische Chemie. Wiley-VCH, 2013, ISBN 978-3-527-33019-5, S. 178 (eingeschränkte Vorschau in der Google-Buchsuche).
