Als Enders-Reagenz bezeichnet man die beiden stereoisomeren chemischen Verbindungen (S)-(−)- und (R)-(+)-1-Amino-2-methoxymethylpyrrolidin, die häufig SAMP oder RAMP abgekürzt werden. Benannt sind die beiden Stickstoff-Heterocyclen nach Dieter Enders. Sie werden als chirale Auxiliare eingesetzt, d. h. als Hilfsstoffe, die durch ihre eigene stereochemische Information bei einer chemischen Synthese die Reaktion zu einem erwünschten Endprodukt mit festgelegter Stereochemie steuern und anschließend wieder abgespalten werden (können).
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
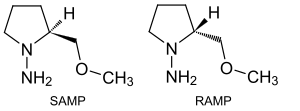
| ||||||||||
| Allgemeines | ||||||||||
| Name | Enders-Reagenz | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C6H14N2O | |||||||||
| Kurzbeschreibung |
hellgelbe Flüssigkeit[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 130,21 g·mol−1 | |||||||||
| Dichte |
0,97 g·cm−3 (25 °C)[2] | |||||||||
| Siedepunkt | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Darstellung
BearbeitenSAMP wird in einer vierstufigen Synthese aus L-Prolin [Synonym: (S)-Prolin] hergestellt.[4] Das Enantiomer von SAMP – also (R)-(+)-1-Amino-2-methoxymethylpyrrolidin (RAMP) – kann aus D-Prolin [Synonym: (R)-Prolin] oder (R)-Glutaminsäure in einer sechsstufigen Synthese hergestellt werden.[4]
Analytik
BearbeitenEine gaschromatographische Methode zur Bestimmung der Enantiomerenreinheit von SAMP und RAMP wurde in der Literatur beschrieben.[5]
Verwendung
BearbeitenSAMP und RAMP werden in der enantioselektiven Synthese als chirale Auxiliare eingesetzt. Unter Anwendung der SAMP-/RAMP-Hydrazonmethode können in α-Stellung chiral alkylierte Ketone und Aldehyde mit guten Enantiomeren- und Diastereomerenüberschüssen synthetisiert werden. Die Reaktion beruht auf der Bildung des Hydrazons aus dem chiralen Auxiliar und dem Edukt, einem Keton oder Aldehyd. Der Sauerstoff der Methoxygruppe wirkt chelatisierend zum Lithiumion von enolatbildenden Basen wie Lithiumdiisopropylamid. Dadurch wird die Stereoinformation, die Stellung der Methoxygruppe, auf das Produkt induziert. Die intermediären Produkte sind Hydrazone, welche mittels Ozonolyse in die Endprodukte überführt werden. Das Auxiliar fällt dabei als Nitroderivat an und kann mit Zink und Essigsäure zum Hydrazin (SAMP bzw. RAMP) reduziert, also rezykliert werden. Viele Naturstoffe, vor allem Pheromone, z. B. (S)-(+)-4-Methyl-3-heptanon, ein Alarmpheromon der Blattschneiderameisen, konnten erfolgreich synthetisiert werden.[6]
Literatur
Bearbeiten- Dieter Enders, Karl-Erich Jaeger: Asymmetric Synthesis with Chemical and Biological Methods. Verlag Wiley-VCH, ISBN 3-527-31473-3.
Weblinks
Bearbeiten- Dieter Enders, Peter Fey, and Helmut Kipphardt: (S)-(−)-1-Amino-2-Methoxymethylpyrrolidine (SAMP) AND (R)-(+)-1-Amino-2-Methoxymethylpyrrolidine (RAMP), Versatile chiral Auxiliaries In: Organic Syntheses. 65, 1987, S. 173, doi:10.15227/orgsyn.065.0173; Coll. Vol. 8, 1993, S. 26 (PDF).
Einzelnachweise
Bearbeiten- ↑ a b c Datenblatt (S)-(−)-1-Amino-2-(methoxymethyl)pyrrolidine bei Sigma-Aldrich, abgerufen am 3. November 2016 (PDF).
- ↑ a b Datenblatt RAMP bei Merck, abgerufen am 9. April 2010.
- ↑ Datenblatt (R)-(+)-1-Amino-2-(methoxymethyl)pyrrolidine bei Sigma-Aldrich, abgerufen am 3. November 2016 (PDF).
- ↑ a b A. Job, C. F. Janeck, W. Bettray, R. Peters, D. Enders: The SAMP/RAMP-Hydrazone Methodology in Asymmetric Synthesis, in: Tetrahedron, 2002, 58, S. 2253–2329. doi:10.1016/S0040-4020(02)00080-7
- ↑ Kurt Günther, Jürgen Martens und Maren Messerschmidt: Gas Chromatographic Separation of Enantiomers: Determination of the Optical Purity of the Chiral Auxiliaries (R)- and (S)-1-Amino-2-methoxymethylpyrrolidine, in: Journal of Chromatography A, 1984, 288, S. 203–205, doi:10.1016/S0021-9673(01)93696-9.
- ↑ Dieter Enders, Helmut Kipphardt, and Peter Fey: Asymmetric Syntheses using the SAMP-/RAMP-Hydrazone Method: (S)-(+)-4-Methyl-3-Heptanone In: Organic Syntheses. 65, 1987, S. 183, doi:10.15227/orgsyn.065.0183; Coll. Vol. 8, 1993, S. 403 (PDF).