Scandiumoxid (Sc2O3) ist das Verbrennungsprodukt von elementarem Scandium an Luft. Es entsteht bei der Oxidation von Scandium zu Sc3+ bei 800 °C oder durch Glühen von Scandiumsalzen. Es ist ein weißes Pulver mit einem Schmelzpunkt von 2485 °C.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| _ Sc3+ _ O2− | ||||||||||||||||
| Kristallsystem | ||||||||||||||||
| Raumgruppe |
Ia3 (Nr. 206) | |||||||||||||||
| Gitterparameter |
a = 985 pm | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Scandiumoxid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | Sc2O3 | |||||||||||||||
| Kurzbeschreibung |
weißer, geruchloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 137,91 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
3,86 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Brechungsindex |
1,9943[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Eigenschaften
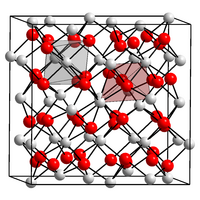
BearbeitenScandiumoxid kristallisiert im kubischen Kristallsystem in der Raumgruppe Ia3 (Raumgruppen-Nr. 206) mit dem Gitterparameter a = 985 pm und 16 Formeleinheiten pro Elementarzelle. In der Kristallstruktur sind die Sc3+-Kationen sechsfach von Sauerstoff in Form von Oktaedern koordiniert. Strukturell entspricht Sc2O3 damit den Lanthanoid-Oxiden des C-Typs, der auch bei den Strukturen von Lanthanoid-Sesquioxiden der allgemeinen Form Ln2O3 für Ln = Dy–Lu und Y vorkommt.[3]
Verwendung
BearbeitenVerwendet wird Scandiumoxid zur Dotierung von Magnetspeichern in der Computerindustrie. Dabei wird die Ummagnetisierung beschleunigt und somit die Rechenleistung erhöht. Es stellt das Ausgangsprodukt zur Herstellung des Metalls Scandium dar. Es wird hierbei in Scandium(III)-fluorid (ScF3) überführt und dann mittels Calcium zum Metall reduziert.
Einzelnachweise
Bearbeiten- ↑ a b c d Eintrag zu Scandiumoxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 12. Dezember 2012. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Index of Refraction of Inorganic Crystals, S. 10-248.
- ↑ Osvald Knop, Jean M. Hartley: Refinement of the crystal structure of scandium oxide. In: Canadian Journal of Chemistry. 46 (8), 1968, S. 1446–1450, doi:10.1139/v68-236.