Schottky-Defekte (auch: Schottky-Fehlordnung, nach Walter Schottky) gehören zu den Gitterfehlern in Kristallgittern. Sie sind intrinsische Punktdefekte, bei denen Paare von Leerstellen in einem Ionengitter auftreten. Im einfachsten Fall fehlt jeweils im Anionen- und im Kationenteilgitter ein Ion. Gelegentlich wird auch eine einzelne Leerstelle in einem Ionengitter schon als Schottky-Defekt bezeichnet.
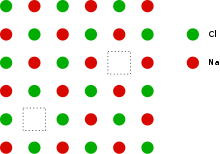
Dagegen hat sich bei einem Frenkel-Defekt ein Ion von einem regulären Gitterplatz auf einen Zwischengitterplatz begeben und dabei eine Leerstelle zurückgelassen.
Frenkel- und Schottky-Defekte werden als Eigendefekte bezeichnet, welche die Stöchiometrie eines Kristalls nicht verändern.[1]
Beschreibung
BearbeitenDie Schottky-Fehlordnung wird dadurch erzeugt, dass oberflächennahe Ionen ihren Gitterplatz verlassen, an die Oberfläche des Kristalls abwandern und sich dort anlagern. Die entstehenden Leerstellen können sich durch Leerstellenwanderung im Kristall bewegen. Sie können daher wesentlich zum Stofftransport und zur Reaktivität eines Festkörpers beitragen.[2]
Schottky-Defekte sind eine natürliche Eigenschaft vieler Ionenkristalle, d. h. sie liegen im chemischen Gleichgewicht vor. Sie treten vorwiegend in Verbindungen auf, in denen aufgrund des Fehlens passender Zwischengitterplätze eine Frenkel-Fehlordnung nur schwer möglich ist.[3] Beispiele für solche Kristalle sind die Alkalihalogenide wie Natriumchlorid und Kaliumchlorid.
Die Konzentration der Leerstellen („Defektkonzentration“) kann formal über eine Art Massenwirkungsgesetz beschrieben werden. Die Anzahl der Schottky-Defekte nimmt mit steigender Temperatur zu, weil durch sie die Entropie erhöht wird (energetisch sind sie ungünstig). Für die Konzentration bzw. Dichte der Schottky-Defekte in einem Kristall gilt folgende Proportionalität:
mit
- als materialabhängiger Bildungsenergie der Schottky-Defekte
- als Boltzmann-Konstante
- als absoluter Temperatur.
Einzelnachweise
Bearbeiten- ↑ Walter J. Moore: Grundlagen der Physikalischen Chemie. Walter de Gruyter, 1990, ISBN 978-3-11-009941-6, S. 753 (books.google.de).
- ↑ C. Kittel: Einführung in die Festkörperphysik. 7. Auflage, Oldenbourg, 1986, ISBN 3-486-20240-5, S. 584 ff.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1621.