Strontiumcarbonat, auch veraltet Kohlensaures Strontium, ist das Carbonat des Strontiums. Es besitzt die Summenformel SrCO3.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
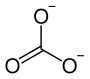
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Strontiumcarbonat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | SrCO3 | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 147,63 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
3,5 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
Zersetzung ab 1200 °C[1] | |||||||||||||||
| Löslichkeit |
sehr schlecht in Wasser (0,01 g·l−1 bei 18 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−1220,1 kJ/mol[3] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Vorkommen
BearbeitenStrontiumcarbonat findet sich in der Natur als Mineral Strontianit.
Darstellung
BearbeitenDie Darstellung von Strontiumcarbonat erfolgt durch Verschmelzen des Minerals Cölestin (SrSO4) mit Soda (Natriumcarbonat):
Eigenschaften
BearbeitenStrontiumcarbonat ist ein feines, weißes Pulver, das ähnliche Eigenschaften wie Calciumcarbonat besitzt. Das Salz dient als Ausgangsmaterial für die Gewinnung der meisten Strontiumverbindungen.
Strontiumcarbonat löst sich nicht in reinem, jedoch in Kohlendioxid/Kohlensäure-haltigem Wasser. Dabei bildet sich Strontiumhydrogencarbonat:
In Mineralsäuren entstehen aus Strontiumcarbonat lösliche Strontiumsalze. Man beobachtet die Entstehung von Kohlensäure, die weiter zu Wasser und Kohlendioxid zerfällt.
Bei 1268 °C unter normalem Luftdruck spaltet sich die chemische Verbindung in Strontiumoxid und Kohlendioxid:
Erhöht man den Luftdruck auf ca. 70 bar, so schmilzt Strontiumcarbonat bei 1497 °C.
Verwendung
BearbeitenStrontiumcarbonat wird in Ferritmagneten eingesetzt und dient in Farbfernsehröhren als Absorber für Röntgenstrahlung.[4] Elektrolyse-Zink lässt sich mit Strontiumcarbonat reinigen. Zudem findet es in Glasuren und wegen der roten Flammenfärbung in der Pyrotechnik Verwendung.
In der Medizin wurde es früher gelegentlich zur Behandlung von Schizophrenien eingesetzt. Wegen der Verfügbarkeit verträglicherer Mittel wird es jedoch nicht mehr angewandt. Heute ist der Stoff nur noch in der Homöopathie unter dem Namen Strontium carbonicum im Einsatz, zum Beispiel bei Arthrose und Zerebralsklerose.
In der organischen Synthese kann Strontiumcarbonat zusammen mit Wasserstoff und Palladium zur selektiven Reduktion von Doppelbindungen eingesetzt werden.[5]
Quellen
Bearbeiten- ↑ a b c d e f Eintrag zu Strontiumcarbonat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 19. Dezember 2019. (JavaScript erforderlich)
- ↑ Richard C. Ropp: Encyclopedia of the Alkaline Earth Compounds. Newnes, 2012, ISBN 0-444-59553-8, S. 367 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-20.
- ↑ M. Binnewies et alii: Allgemeine und Anorganische Chemie. 2. Auflage. Spektrum, 2010, ISBN 3-8274-2533-6, S. 383.
- ↑ Michael B Smith: Organic Synthesis. Academic Press, 2011, S. 431 (eingeschränkte Vorschau in der Google-Buchsuche).