Die Familie Togaviridae (Togaviren) umfasst derzeit zwei Gattungen von behüllten Viren (lat. toga: Mantel) mit einer einzelsträngigen RNA mit positiver Polarität. Zu den Togaviridae gehören in der Gattung Alphavirus wichtige Virusarten, die durch Insekten Krankheiten auf Menschen und Tiere übertragen.
| Togaviridae | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||
| Systematik | ||||||||||||||
| ||||||||||||||
| Taxonomische Merkmale | ||||||||||||||
| ||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||
| Togaviridae | ||||||||||||||
| Links | ||||||||||||||
|


Morphologie
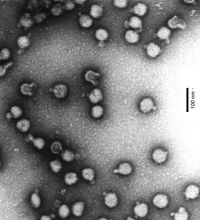
BearbeitenDie kugelförmigen Viruspartikel (Virionen) der Togaviridae sind etwa 70 nm im Durchmesser groß und von einer Lipidmembran (Virushülle) umgeben. In der Hülle sind als deutliche Spikes Heterodimere der beiden viralen Hüllproteine E1 und E2 (45-58 kDa) eingelagert. Innerhalb der Gattung Alphavirus lagern sich die Heterodimere wiederum zu 80 Trimeren zusammen und bilden eine (sonst nur bei Kapsiden vorkommende) ikosaedrische Hüllstruktur. Bei einigen Alphaviren kann noch ein drittes Hüllprotein E3 (10 kDa) hinzutreten.
Sehr eng an die Hülle angelagert findet sich im Innern ein etwa 40 nm im Durchmesser großes Kapsid aus 240 Molekülen des Coreproteins CP (30-33 kDa) mit einer ikosaedrischen Symmetrie (T=4). Das feststehende Verhältnis von Hüllproteinen zu Kapsidproteinen (1:1) ist besonders beim Zusammenbau der Kapside der Alphaviren von Bedeutung.
Das Kapsid des Rubellavirus (Gattung Rubivirus) besteht aus 180 Homodimeren des Coreproteins in einer ikosaedrischen Symmetrie (T=3) und hat keine so enge Assoziation zur Virushülle wie bei Alphaviren; das Rubellavirus ist deshalb in seiner Form oft variabel. Diese Gattung wurde vom ICTV 2018/2019 mit der Master Species List #34 in eine eigene Familie Matonaviridae verschoben.[2]
Das Genom der Togaviridae besteht aus einer einzelsträngigen, linearen RNA mit positiver Polarität ((+)ssRNA) und ist 9,7 bis 11,8 kb groß. An ihrem 5'-Ende befindet sich eine 5'-Cap-Struktur, es folgen die Sequenzen für die meist vier Nicht-Strukturproteine (nsP1-4), die Strukturproteine (CP, E1, E2) und am 3'-Ende ein Poly(A)-Schwanz. Damit kann das Genom als messenger-RNA (mRNA) für die Translation dienen.
Replikation
BearbeitenTogaviren heften sich über spezifische Rezeptoren an der Zelloberfläche an und werden durch ein sich ausbildendes Endosombläschen aufgenommen. Bei neutralem pH-Wert außerhalb der Zelle deckt das E2-Hüllprotein das E1-Protein ab. Im Innern des Endosoms werden nun bei saurem pH-Wert die äußeren Domänen des E1-Proteins freigelegt, die eine Fusionssequenz beinhalten und die Fusion von Endosommembran und Virushülle induzieren. Damit wird das Kapsid in das Zytosol freigesetzt, zerfällt und gibt das Genom frei.
Die (+)ssRNA dient zunächst nur der Translation der Nicht-Strukturproteine, die als großes Polyprotein synthetisiert und durch zelluläre Signalpeptidasen von diesem abgespalten werden. Die Sequenzen für die Strukturproteine werden hingegen erst über eine komplementäre (−)ssRNA als Matrize durch die virale RNA-Polymerase (Replikase) vervielfältigt und als eigene kurze mRNA translatiert. Diese kurze (subgenomische) mRNA wird beim Rubellavirus auch zusätzlich in das Virion verpackt.
Nach der Synthese der neuen genomischen RNA und der viralen Strukturproteine beginnt der Transport der glykosylierten Hüllproteine vom endoplasmatischen Retikulum (ER) über den Golgi-Apparat zur Zellmembran. Hier findet schließlich der Zusammenbau von Hülle und Kapsid und die Knospung (Budding) neuer Virionen statt. Bei Alphaviren wird das Kapsid mit der RNA bereits vorher gebildet, beim Rubellavirus beginnt die Kapsidbildung erst mit der Anlagerung vorwiegend an die Membran des ER statt, von der auch die Knospung des Rubellavirus geschieht.
Systematik
BearbeitenInnere Systematik
BearbeitenDie folgende Gliederung der Togaviridae folgt den Vorgaben des International Committee on Taxonomy of Viruses (ICTV) mit Stand Februar 2019,[2][3] die Gruppen vom Rang einer Untergattung haben vorschlagsmäßigen Character und sind bisher nicht vom ICTV bestätigt, ebenso die in Anführungszeichen aufgeführten Spezies.
- Familie Togaviridae
- Genus Alphavirus (früher Arbovirus A)
- Gruppe ‚Barmah Forest virus complex’ (BFV-Komplex oder BFV-Gruppe, evtl. zur SFV-Gruppe, s. u.)
- Spezies Barmah-Forest-Virus (en. Barmah Forest virus, BFV)
- Gruppe ‚Eastern equine encephalitis complex’ (EEEV-Gruppe)
- Spezies Östliches Equines Encephalomyelitis-Virus (auch Östliches-Pferdeenzephalitis-Virus, en. Eastern equine encephalitis virus, EEEV)
- Gruppe ‚Middelburg virus complex’ (MIDV-Komplex oder MIDV-Gruppe, evtl. zur SFV-Gruppe, s. u.)
- Spezies Middleburg-Virus (en. Middelburg virus, MIDV)
- Gruppe ‚Ndumu virus complex’ (NDUV-Komplex oder NDUV-Gruppe)
- Spezies Ndumu-Virus (en. Ndumu virus, NDUV)
- Gruppe ‚Semliki Forest virus complex’ (SFV-Komplex oder SFV-Gruppe)
- Spezies Bebaru-Virus (en. Bebaru virus)
- Spezies Chikungunya-Virus (en. Chikungunya virus, CHIKV)
- Spezies Getah-Virus (en. Getah virus, GETV)
- Spezies Mayaro-Virus (en. Mayaro virus, MAYV)
- Spezies O'nyong-nyong-Virus (en. Onyong-nyong virus, ONNV)
- Spezies Ross-River-Virus (en. Ross River virus, RRV)
- Spezies Semliki-Forest-Virus (en. Semliki Forest virus, SFV)
- Gruppe ‚Venezuelan equine encephalitis complex’ (VEEV-Gruppe)
- Spezies Cabassou-Virus (en. Cabassou virus, CABV)
- Spezies Everglades-Virus (en. Everglades virus, EVEV)
- Spezies Mosso-das-Pedras-Virus (en. Mosso das Pedras virus, MDPV)
- Spezies Mucambo-Virus (en. Mucambo virus, MUCV)
- Spezies Paramana-Virus (en. Paramana virus)
- Spezies Pixuna-Virus (en. Pixuna virus, PIXV)
- Spezies Rio-Negro-Virus (en. Rio Negro virus, RNV)
- Spezies Trocara-Virus (en. Trocara virus)
- Spezies VEE-Virus (en. Venezuelan equine encephalitis virus, VEEV)
- Gruppe ‚Western equine encephalitis complex’ (WEEV-Gruppe)
- Spezies Aura-Virus (en. Aura virus)
- Spezies Sindbis-Virus (en. Sindbis virus, SINV)
- Subtyp Babanki-Virus (en. Babanki virus)
- Subtyp Kyzylagach-Virus (en. Kyzylagach virus, KYZV)
- Subtyp Ockelbo-Virus (en. Ockelbo virus, OCKV)
- Spezies Whataroa-Virus (en. Whataroa virus)
- Spezies Fort-Morgan-Virus (alt Buggy-Creek-Virus, en. Fort Morgan virus, FMV)
- Spezies Highlands-J-Virus (en. Highlands J virus, HJV)
- Spezies Westliches Equines Encephalomyelitis-Virus (auch Westliches-Pferdeenzephalitis-Virus, en. Western equine encephalitis virus, WEEV)
- ohne vorgeschlagene Gruppe:
- Spezies Eilat-Virus (en. Eilat virus, EILV)
- Spezies ‚Mwinilunga-Virus‘ (en. ‚Mwinilunga alphavirus‘, MWAV)
- Spezies Salmon pancreas disease virus (alias Salmon pancreatic disease virus, SPDV)
- Spezies ‚Rainbow trout sleeping disease virus‘ (RTSDV)
- Spezies Southern elephant seal virus (SESV)
- Spezies Tonate-Virus (en. Tonate virus, TONV)
- Spezies Una-Virus (en Una virus, UNAV)
- Spezies ‚Triniti-Virus‘ (en. Trinity virus, TNTV)[4]
- Gruppe ‚Barmah Forest virus complex’ (BFV-Komplex oder BFV-Gruppe, evtl. zur SFV-Gruppe, s. u.)
- Genus Alphavirus (früher Arbovirus A)
Die Gattung Rubivirus (mit der Spezies Rötelnvirus, englisch Rubella virus, RuV) wurde vom ICTV 2018/2019 in eine eigene Familie Matonaviridae, seit März 2020 Ordnung Hepelivirales in derselben Klasse, gestellt.[2]
Äußere Systematik
BearbeitenKoonin et al. haben 2015 die Togaviridae taxonomisch (aufgrund ihrer Verwandtschaft) der von ihnen postulierten Supergruppe ‚Alphavirus-like superfamily‘ zugeordnet.[5] Schwestergruppe ist danach die Familie Hepeviridae.[6] Die Mitglieder dieser vorgeschlagenen Supergruppe gehören verschiedenen Gruppen der Baltimore-Klassifikation an, in der Regel handelt es sich um einzelsträngige RNA-Viren positiver Polarität ((+)ssRNA, Baltimore-Gruppe 4), es sind aber auch doppelsträngige Vertreter (mit dsRNA gekennzeichnet, Baltimore-Gruppe 3) zu finden.
Dieser Vorschlag ist inzwischen abgelöst durch die Master species List #35 des ICTV vom März 2020.[1] Eine Gegenüberstellung der Kladogramme findet sich bei Tymovirales §ICTV Master Species List #35.
Literatur
Bearbeiten- Richard J. Kuhn: Togaviridae: The viruses and their replication. In: David M. Knipe, Peter M. Howley (Hrsg.): Fields’ Virology. 5. Auflage. Lippincott Williams & Wilkins, Philadelphia 2007, ISBN 978-0-7817-6060-7.
- C.M. Fauquet, M.A. Mayo et al.: Eighth Report of the International Committee on Taxonomy of Viruses. London / San Diego 2004
Weblinks
BearbeitenEinzelnachweise
Bearbeiten- ↑ a b c d e ICTV: ICTV Master Species List 2019.v1, New MSL including all taxa updates since the 2018b release, March 2020 (MSL #35)
- ↑ a b c d ICTV Master Species List 2018b v1. MSL #34, Feb. 2019
- ↑ ICTV: Master Species List 2018a v1 ( des vom 14. März 2019 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis., MSL (#33) including all taxa updates since the 2017 release. Herbst 2018
- ↑ Google Patents: RU2350622C2 “Conjugate of angiotensin peptide component with carrier, vaccine composition, method of animal immunisation and method of treatment or prevention of physical disorder related to angiotensin system activated by renin”
- ↑ Da diese Gruppe (von den Autoren als englisch superfamily bezeichnet) mit den Tymovirales eine Ordnung enthält, muss ihr Rang höher sein als dieser und ist nicht etwa als Überfamilie zu verstehen. Ränge höher als Ordnung waren zum Zeitpunkt der Arbeit vom ICTV aber noch gar nicht vorgegeben.
- ↑ Eugene V. Koonin, Valerian V. Dolja, Mart Krupovic: Origins and evolution of viruses of eukaryotes: The ultimate modularity. In: Virology, Mai 2015, S. 479–480. 2–25, Epub 12. März 2015, PMC 5898234 (freier Volltext), PMID 25771806