Apfelschorf
Der Apfelschorf (Venturia inaequalis) ist eine der wichtigsten Apfelbaumkrankheiten weltweit und wird durch den Schlauchpilz Venturia inaequalis verursacht. Die Nebenfruchtform wird als Spilocaea pomi bezeichnet. Der Gattungsname ehrt den italienischen Botaniker Antonio Venturi (1805–1864), nicht den Bryologen Gustavo Venturi.[1]
| Apfelschorf | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Befallener Apfel | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Venturia inaequalis | ||||||||||||
| (Cooke) G. Winter |


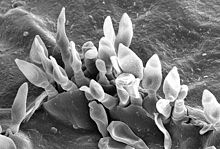

Merkmale
BearbeitenDer Befall zeigt sich an den Blättern mit matt-olivgrünen, später braunen oder schwärzlichen Flecken, die zusammenfließen können, und in der Folge größere Nekrosen bilden, was zu einem vorzeitigen Blattverlust der Bäume führt. Die Früchte weisen meist dunkler gefärbte Flecken auf, in denen meist sternförmige Risse auftreten, die Fäulniserregern wie Monilia als Eintrittspforte dienen. Damit wird die Lagerfähigkeit des Obstes beeinträchtigt. Die Früchte selbst können jedoch bedenkenlos verzehrt werden. Auch junge Triebe können infiziert werden.
Die Primärinfektion des Wirtes erfolgt im Frühjahr, von den am Boden liegenden kranken Blättern des Vorjahres aus, auf denen sich bis zur Zeit des Laubaustriebes die Pseudothecien gebildet haben. Sie besitzen kleine dunkle Haare rund um die Öffnung und enthalten Pseudoparaphysen. Bei günstiger Witterung wie hohe Luftfeuchtigkeit, werden aus den Asci acht zweizellige Ascosporen aktiv ausgeschleudert und gelangen mit dem Wind auf den Wirt. Dort keimen die Ascosporen unter günstigen Bedingungen (10 bis 20 Stunden Nässe bei 10 bis 20 °C) beispielsweise auf nassen Blättern aus und infizieren den Wirt. Die ersten Symptome erscheinen nach einer bis drei Wochen.
Die Ausbreitung des Pilzes und damit der Krankheit im Sommer erfolgt durch die Konidien, die im Bereich der Flecken und Nekrosen in großer Zahl gebildet werden. Sie werden in erster Linie durch den Regen verspritzt.
Ökologie
BearbeitenDer Apfelschorf benötigt eine hohe Feuchtigkeit und befällt deshalb besonders in Frühjahren und Sommern mit vielen Niederschlägen Blätter und Früchte. Eine präzise Befallsprognose ist möglich. Damit kann der Zeitpunkt für den prophylaktischen Fungizideinsatz zur Verhinderung der Krankheit optimal bestimmt werden.
Infektionsgefahr
BearbeitenOb eine Infektion stattfindet, hängt von Temperatur und Zeit ab.[2]
| Temperatur (°C) | Zeit (h) | Temperatur (°C) | Zeit (h) |
|---|---|---|---|
| 1 | 37 | 10 | 11 |
| 2 | 32,5 | 11 | 9 |
| 3 | 32 | 12 | 8 |
| 4 | 29 | 13 | 8 |
| 5 | 21 | 14 | 7 |
| 6 | 18 | 15 | 7 |
| 7 | 15 | 16–24 | 6 |
| 8 | 13 | 25 | 8 |
| 9 | 12 | 26 | 11 |
Maßnahmen
BearbeitenIm Anbau
BearbeitenNeben der Wahl der Sorte gibt es eine Reihe von vorbeugenden Maßnahmen, die den Befall zumindest reduzieren können. Dabei werden einerseits das Falllaub verringert durch Blattspritzungen mit Blattdüngern oder Zerkleinerung des Falllaubes durch Mulchen. Andererseits wird durch Schnitt und Erziehungsform der Baumkrone eine gute Belüftung und schnelleres Abtrocknen der Blätter gesichert, die Infektionsbedingungen von Nässe und Temperatur werden so beeinflusst. Durch Förderung eines zeitigen Triebabschlusses werden zudem Neuinfektionen an jungen empfindlichen Blättern bis weit in den Spätsommer verhindert. Im ökologischen Landbau sind als direkte Maßnahmen Schwefel und Kupferverbindungen wie zum Beispiel Kupferoxychlorid als Pflanzenschutzmittel zugelassen.
Auch der Schutz der Bäume von äußerer Feuchtigkeit wie Regen erweist sich als wirkungsvoll[3]. In diesem Zusammenhang gilt auch die Nutzung von Agri-PV zum Schutz vor Niederschlägen als vielversprechend[4].
Resistenzzucht
BearbeitenKlassische Züchtung
BearbeitenDie Anfälligkeit gegenüber Schorf ist sortenabhängig. Dabei sind mehrere mono- und polygene Resistenzgene bekannt. Seit Mitte des 20. Jahrhunderts existieren Bestrebungen, den Kulturapfel mit resistenten Malus-Sorten zu kreuzen, und daraus schorfresistente Sorten zu züchten. Bei Schorf sind die Resistenzquellen von Antonovka (Va), Hansens baccata (Vb), Malus baccata jackii (Vbj), Malus floribunda (Vf), Malus micromalus (Vm) und Malus pumila (Vr) bekannt.[5] Dazu diente bisher vor allem Malus floribunda.[6] Aus diesen Züchtungsprogrammen entstammen resistente Apfelsorten wie „Florina“, „Liberty“, „Rewena“, „Retina“, „Reanda“, „Remo“, „Topaz“ und andere. Das häufig eingekreuzte monogene Rvi6- (vormals Vf-) Resistenzgen stammt von der Wildapfellinie Malus floribunda 821. In Einzelfällen wurde dessen Resistenz bereits vom Pathogen durchbrochen.[7] Moderne Züchtung stützt daher darauf ab, mehrere noch undurchbrochene Resistenzgene zu pyramidisieren, um so eine stabilere langanhaltende Resistenz zu gewährleisten.[8] Dies geschieht, indem ein Nachkomme einer anfälligen Sorte und einer resistenten Sorte erneut mit einer resistenten Sorte gekreuzt wird, deren Resistenz auf einem anderen Gen basiert. Nach mehreren Rückkreuzungen mit qualitativ guten Sorten kann eine neue Sorte mit zwei oder mehr Resistenzgenen hervorgebracht werden, welche den Qualitätsanforderungen auf dem Markt entspricht. Aufgrund der langen Juvenilphase des Apfels dauert dieser Prozess allerdings bis zu 25 Jahre.[9] Bis zum Jahre 2009 wurden bei einem Forschungsprojekt in der Schweiz 600 verschiedene Apfelsorten auf Schorfanfälligkeit geprüft.[10]
Gentechnik
BearbeitenUm die Züchtung von neuen robusten Sorten zu verkürzen, werden sowohl cisgene wie auch transgene Methoden eingesetzt. Bei der cisgenen Methode werden Resistenzgene von Wildäpfeln direkt in bestehende Sorten (zum Beispiel Royal Gala) eingesetzt. Dadurch, dass dieses Resistenzgen von einem natürlichen Kreuzungspartner stammt, könnte die cisgene Sorte ebenfalls durch klassische Züchtung gezüchtet werden. Das Erbgut dieser Sorten stammt somit vollständig vom Apfel. Durch die Anwendung der cisgenen Methode kann die Züchtungsdauer markant reduziert werden.[11] Die zweite Methode, welche angewendet wird, ist die transgene Blühverfrühung. Hierbei wird dem Züchtungsmaterial ein Gen der Birke eingesetzt, welches bewirkt, dass der Apfelbaum bereits einige Monate nach der Aussaat blüht. Folglich verkürzen sich die Juvenilphase und die Zuchtdauer um bis zu 95 Prozent. Die gezüchtete Sorte enthält das Transgen am Ende nicht, da im letzten Schritt nach der Kreuzung von transgenen mit normalen Äpfeln nur Genotypen selektiert werden, die nicht verfrüht blühen.[12]
Nachweise
Bearbeiten- Venturia inaequalis. In: Gehölzkrankheiten in Wort und Bild. Studienfakultät für Forstwissenschaft und Ressourcenmanagement der Technischen Universität München, archiviert vom (nicht mehr online verfügbar) am 10. Juni 2007; abgerufen am 20. Februar 2010.
- Wolfgang Kreckl: Apfelschorf (Venturia inaequalis). In: Fachbeiträge aus dem Institut für Pflanzenschutz. Bayerische Landesanstalt für Landwirtschaft, abgerufen am 18. September 2015.
Weblinks
BearbeitenEinzelnachweise
Bearbeiten- ↑ Lotte Burkhardt 2022: Eine Enzyklopädie zu eponymischen Pflanzennamen: Von Menschen & ihren Pflanzen – Berlin: Botanic Garden and Botanical Museum Berlin, Freie Universität Berlin. – doi:10.3372/epolist2022, Berlin 2022.
- ↑ Obstbau-Handbuch der Obstbauversuchsanstalt Jork, 2011.
- ↑ Roland Weber, Sascha Buchleiter: Was lässt sich aus der Infektionsbiologie der Regenfleckenpilze für die Regulierung ableiten? In: Öko-Obstbau. Band 3, 2022 (kob-bavendorf.de [PDF]).
- ↑ Brigitte Werner-Gnann: Oben Strom und unten Äpfel. In: BWagrar. 4. Mai 2022, abgerufen am 1. November 2023.
- ↑ Abwehrmechanismen und Resistenzen bei Kernobst. ( des vom 7. November 2017 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. In: Fachinformationen. Staatliche Lehr- und Versuchsanstalt für Wein- und Obstbau Weinsberg, online auf LVWO-bw.de, abgerufen am 9. Februar 2017.
- ↑ Bernhard Koller, Cesare Gessler u. a.: Technikfolgen des Einsatzes gentechnisch veränderter krankheitsresistenter Nutzpflanzen – Teil Apfel. Fachstudie Technikfolgen Apfel. Eidgenössische Forschungsanstalt für Obst-, Wein- und Gartenbau Wädenswil, Zürich 12. Oktober 1995, auf BATS.ch, abgerufen am 9. Februar 2017 (PDF; 351 kB).
- ↑ Hans-Jakob Schärer, Markus Kellerhals: Schorfdurchbruch bei Vf-resistenten Apfelsorten? ( des vom 13. Februar 2017 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. In: Schweizerische Zeitschrift für Obst- und Weinbau. Ausg. 7, 2000, auf Agroscope.admin.ch, abgerufen am 13. Februar 2017 (PDF; 224 kB), S. 124–126.
- ↑ M. Kellerhals, T. Székely, C. Sauer, J. E. Frey, A. Patocchi: Pyramidisieren von Schorfresistenzen in der Apfelzüchtung. In: Erwerbs-Obstbau. Band 51, Nr. 1, Februar 2009, S. 21–28, doi:10.1007/s10341-009-0078-3.
- ↑ T. Visser: Juvenile Phase and Growth of Apple and Pear Seedlings. In: Euphytica. Band 13, Nr. 2, 1964, doi:10.1007/bf00033299.
- ↑ Claudia Rindt: Die Hüter der Obst-Raritäten. In: Südkurier. 29. September 2007, auf Suedkurier.de, abgerufen am 13. Februar 2017.
- ↑ Schorfresistente Äpfel – Mit Gentechnik zum „Bio-Apfel“? Auf Pflanzen-Forschung-Ethik.de, abgerufen am 13. Februar 2017.
- ↑ Henryk Flachowsky, Pierre-Marie Le Roux, Andreas Peil, Andrea Patocchi, Klaus Richter, Magda-Viola Hanke: Application of a high-speed breeding technology to apple (Malus × domestica) based on transgenic early flowering plants and marker-assisted selection. In: New Phytologist. Band 192, Nr. 2, Oktober 2011, S. 364, doi:10.1111/j.1469-8137.2011.03813.x (englisch).