Anagrelid ist ein Arzneistoff aus der Gruppe der Imidazolidinon-Verbindungen. Anagrelid verringert die Anzahl der im Knochenmark gebildeten Blutplättchen und verringert auf diesem Weg die Zahl der im Blut zirkulierenden Blutplättchen wieder auf ein normales Maß. Er wird in der Therapie von Thrombozytosen verwendet, die bei Patienten mit myeloproliferativen Erkrankungen wie der essentiellen Thrombozythämie (ET), Polycythaemia vera (PV), der chronisch-myeloischen Leukämie (CML) oder der Osteomyelofibrose (OMF) vorkommen.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
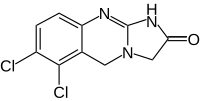
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Anagrelid | ||||||||||||||||||
| Andere Namen |
6,7-Dichlor-1,5-dihydroimidazo[2,1-b]chinazolin-2-on | ||||||||||||||||||
| Summenformel | C10H7Cl2N3O | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | |||||||||||||||||||
| Wirkstoffklasse | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 256,09 g·mol−1 | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Wirkungsmechanismus
BearbeitenNachdem dem Arzneistoff ursprünglich eine hemmende Wirkung auf die Verklumpung von Blutplättchen (Thrombozytenaggregationshemmung) zugeschrieben wurde, haben klinische Studien gezeigt, dass die Substanz keinen Einfluss auf die Thrombozytenfunktion hat, aber dennoch zu einem schnellen Abfall der Thrombozytenzahl im Blut führt. Der genaue Mechanismus der Wirkungsweise ist noch unklar. Es ist jedoch bekannt, dass Anagrelid die cAMP-Phosphodiesterase Typ 3 hemmt.[4] Basierend auf Untersuchungen in Zellkulturen wird diskutiert, dass die Substanz in den Vorläuferzellen der Thrombozyten (Megakaryozyten) wirkt, indem sie deren Reifung verlangsamt und ihre Größe und Ploidie verringert.[5]
Nebenwirkungen
Bearbeiten- häufig: Kopfschmerzen, Schwindel, Müdigkeit, starker Herzschlag, Übelkeit, Durchfall, Anämie
Die Therapie erfordert eine klinische Überwachung des Patienten bezüglich Blutbild, Nieren- und Leberfunktion. Nach der Markteinführung wurden bei Patienten ohne Verdacht auf eine Herzerkrankung, mit Normalbefunden bei vor der Behandlung durchgeführten Herz-Kreislauf-Untersuchungen, schwerwiegende kardiovaskuläre Nebenwirkungen beobachtet. Anagrelid ist bei Patienten jeden Alters mit bekannter oder mit Verdacht auf Herzerkrankung vorsichtig anzuwenden und bei Risikopatienten als Zweitlinientherapie vorgesehen.[6]
Vergleich Anagrelid versus Hydroxycarbamid
BearbeitenEine 2005 im „New England Journal of Medicine“ publizierte Studie[7] lässt allerdings vermuten, dass Anagrelid der Referenzsubstanz Hydroxycarbamid unterlegen ist: Über 800 Personen mit essentieller Thrombozythämie, bei denen aufgrund einer hohen Thrombozytenzahl (über 1 Million/µl) und weiterer Kriterien ein hohes Risiko für vaskuläre Komplikationen bestand, erhielten neben niedrigdosierter Acetylsalicylsäure (ASS) von 75 bis 100 mg entweder Anagrelid oder Hydroxycarbamid.
Nach einer Beobachtungszeit von mehr als 3 Jahren hatten – bei vergleichbarer Reduktion der Thrombozytenzahl – in der Anagrelid-Gruppe 14 %, in der Hydroxycarbamid-Gruppe dagegen nur 9 % der Behandelten eine arterielle oder venöse Thrombose oder eine ernsthafte Blutung erlitten. Die Abbruchrate in der Anagrelid-Gruppe war ebenfalls höher. Unter Anagrelid war auch signifikant häufiger eine Transformation in eine Osteomyelofibrose aufgetreten. Die genannte Studie ist jedoch aufgrund methodischer Ungenauigkeiten in die Kritik geraten und die Ergebnisse weiterer laufender Studien sollten abgewartet werden.
Zulassung
BearbeitenAnagrelid ist für die Behandlung von Hochrisiko-Patienten mit ET in Form verschiedener Präparate von verschiedenen Herstellern zugelassen. Die Substanz ist für die Zweitlinientherapie in Deutschland und bereits für die Erstlinientherapie in Österreich und in der Schweiz zugelassen.[8]
Handelsnamen
BearbeitenAgrylin (USA, CDN), Thromboreductin (AT, PL, HU, CH, RO, CZ, SK, LT, LV), Xagrid (D, CH)[9][10][11]
Weblinks
Bearbeiten- Öffentlicher Beurteilungsbericht (EPAR) der Europäischen Arzneimittel-Agentur (EMA) zu: Anagrelid
Literatur
Bearbeiten- M.N. Silverstein et al. In: N. Eng. J. Med., 1988, 318, S. 1292.
- R.M. Petitt et al. In: Semin. Hematol., 1997, 34, S. 51.
- New England Journal of Medicine, 7. Juli 2005; 353, S. 33–45
Einzelnachweise
Bearbeiten- ↑ Eintrag zu Anagrelid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 30. Mai 2014.
- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von 6,7-dichloro-3,5-dihydro-1H-imidazo[2,1-b]quinazolin-2-one im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 29. Mai 2022.
- ↑ Datenblatt 6,7-Dichloro-5,10-dihydroimidazo[2,1-b]quinazolin-2(3H)-one (PDF) bei BLD Pharmatech, Katalognummer: BD114291, abgerufen am 20. Mai 2024.
- ↑ Xagrid. Zusammenfassung der Merkmale des Arzneimittels. (PDF; 300 kB) Europäische Arzneimittel-Agentur, November 2009; abgerufen am 13. März 2010.
- ↑ M. D. Oertel: Anagrelide, a selective thrombocytopenic agent. In: American Journal of Health-System Pharmacy, Band 55, Nummer 19, Oktober 1998, S. 1979–1986, PMID 9784784
- ↑ Rote Hand Brief von Shire im Februar 2013. (PDF; 517 kB) Abgerufen am 6. Februar 2013.
- ↑ Claire N. Harrison, Peter J. Campbell, Georgina Buck, Keith Wheatley, Clare L. East: Hydroxyurea Compared with Anagrelide in High-Risk Essential Thrombocythemia. In: New England Journal of Medicine. Band 353, Nr. 1, 7. Juli 2005, S. 33–45, doi:10.1056/NEJMoa043800, PMID 16000354.
- ↑ Essentielle (oder primäre) Thrombozythämie (ET). Abgerufen am 18. Januar 2021.
- ↑ Rote Liste, 08/2009.
- ↑ Art der Anwendung. (PDF; 144 kB) Pharmazie.com
- ↑ AGES-PharmMed (08/2009).