Zinn(IV)-oxid
Zinn(IV)-oxid, auch Zinndioxid, ist der Hauptbestandteil des Minerals Kassiterit (Zinnstein) und Hauptquelle der Erzeugung von reinem Zinn.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
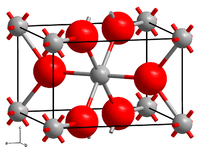
| ||||||||||||||||
| _ Sn4+ _ O2− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Zinn(IV)-oxid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | SnO2 | |||||||||||||||
| Kurzbeschreibung |
amorphes, weißes Pulver oder hexagonale, tetragonale beziehungsweise rhombische Kristalle[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 150,71 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Brechungsindex |
1,9968 (20 °C)[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Gewinnung und Darstellung
BearbeitenZinn(IV)-oxid kann durch Verbrennung von Zinn an Luft, durch Reaktion von Zinn(IV)-chlorid und Wasser (beides als Dampf) bei hohen Temperaturen, sowie durch Reaktion von Zinn mit Schwefelsäure und anschließend mit Hydroxiden gewonnen werden.
Chemische Eigenschaften
BearbeitenDas wasserunlösliche, amphotere Zinndioxid löst sich in starken Säuren wie Salzsäure oder Iodwasserstoffsäure unter Bildung von entsprechenden Hexahalogenstannaten:[5][6]
Mit starken Laugen bilden sich die Salze der teils frei nicht existenten Zinnsäuren H2[Sn(OH)6] und H2SnO3 (Metazinn(IV)-säure). Die entsprechenden Alkalisalze wie Na2SnO3 oder Na2[Sn(OH)6] sind stabil und werden, wie etwa das Natriumstannat Na2[Sn(OH)6] in der Färbeindustrie eingesetzt.
Verwendung
BearbeitenIn der Photovoltaik wird Zinn(IV)-oxid als transparente, elektrisch leitfähige Elektrode bzw. Schicht genutzt, beispielsweise in der Grätzel-Zelle. Da reines Zinn(IV)-oxid elektrisch schlecht leitend ist, wird es dazu mit Antimon (antimondotiertes Zinnoxid, engl. antimony doped tin oxide, ATO) oder Fluor (fluordotiertes Zinnoxid, engl. fluorine doped tin oxide, FTO) versetzt (dotiert), beziehungsweise ist selbst das Dotiermittel wie beim Indiumzinnoxid (engl. indium tin oxide, ITO). Auch in Lichtleitfasern oder LC-Displays – hier dient es als transparente, elektrisch leitfähige Schicht – und in Gassensoren, wo es mit Widerstandsveränderung auf alle oxidierbaren Gase oder Dämpfe reagiert, wird Zinndioxid eingesetzt.
Weiterhin dient es als Poliermehl für Stahl, Glas und Naturstein, als weißes, durchsichtiges Trübungsmittel bei der Herstellung von Keramikglasuren, Milchglas und Email, zur Versiegelung von Rissen in Glas und als Katalysator bei chemischen Prozessen. Früher diente Zinn(IV)-oxid als Glasur bei der Herstellung von Fayencen. Auch als Elektrodenmaterial beim Schmelzen von anorganischen Gläsern kommt es zur Anwendung. Hierbei wird es hauptsächlich als Ersatz für Molybdänelektroden beim Erschmelzen von Bleigläsern eingesetzt.
In elektromechanischen Schaltgeräten, wie z. B. Schützen, besteht das Kontaktmaterial häufig aus Silber mit 2–14 % Massenanteil SnO2. Insbesondere seit viele Hersteller Cadmium vermeiden, wird das vorher verwendete Cadmiumoxid durch Zinnoxid ersetzt.
-
Pulverförmiges Zinndioxid
-
Kassiterit
-
Fayence-Schale mit Zinndioxid-Glasur (1629)
Einzelnachweise
Bearbeiten- ↑ Eintrag zu TIN OXIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 17. Februar 2020.
- ↑ a b c Eintrag zu Zinnoxide. In: Römpp Online. Georg Thieme Verlag, abgerufen am 22. Dezember 2014.
- ↑ a b c d Eintrag zu Zinndioxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 19. Dezember 2019. (JavaScript erforderlich)
- ↑ Datenblatt Tin(IV) oxide, Puratronic®, 99.996% (metals basis) bei Alfa Aesar, abgerufen am 1. Februar 2017 (Seite nicht mehr abrufbar).
- ↑ Donaldson & Grimes: Chemistry of tin ed. P. G. Harrison Blackie (1989).
- ↑ Earle R. Caley: The Action Of Hydriodic Acid On Stannic Oxide. In: J. Am. Chem. Soc., 1932, 54, 8, S. 3240–3243, doi:10.1021/ja01347a028.
Weblinks
Bearbeiten- optische Eigenschaften (PDF; 400 kB)