α-Hämolysin
α-Hämolysin (synonym α-Toxin von S. aureus) ist ein mikrobielles Exotoxin aus Staphylococcus aureus.
| Alpha-hemolysin | ||
|---|---|---|
| ||
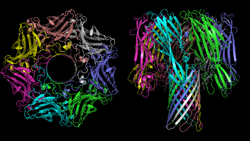
| nach PDB 7AHL | ||
| Andere Namen |
Alpha-toxin (S. aureus), Hla | |
| Masse/Länge Primärstruktur | 319 Aminosäuren, 35.904 Da | |
| Sekundär- bis Quartärstruktur | heptamer | |
| Bezeichner | ||
| Externe IDs | ||
| Orthologe (Staphylococcus aureus) | ||
| Entrez | SAOUHSC_01121 | |
| UniProt | P09616
| |
| PubMed-Suche | SAOUHSC_01121
| |
Eigenschaften
Bearbeitenα-Hämolysin ist ein heptameres porenbildendes Toxin aus der Gruppe der β-porenbildenden Toxine.[1] Es wirkt als Hämolysin. Es ist ein Virulenzfaktor bei einer Infektion mit S. aureus.[2] Die Virulenz ist proportional zur Bildung von α-Hämolysin.[2] Neben dem Panton-Valentine-Leukozidin ist es ein Haupt-Virulenzfaktor bei einer Lungenentzündung in Folge einer Infektion mit S. aureus.[3] Ebenso ist es an der Nekrose der Haut und an tödlichen Verläufen bei Infektionen mit S. aureus beteiligt.[4]
α-Hämolysin besteht strukturell aus 68 % β-Faltblättern und 10 % α-Helices. Jede der sieben Untereinheiten ist mit zwei β-Faltblättern an der Ausbildung der Pore in Form eines β-Fasses beteiligt, mit hydrophilen Aminosäuren auf der Innenseite der Pore.[5] Der Durchmesser der Pore variiert von 14 Ångström an der engsten Stelle bis 46 Å an der weitesten Stelle.[5] Die Pore bevorzugt Anionen.[6]
Die Toxinwirkung entsteht durch Aktivierung des intrinsischen Wegs der Apoptose.[7] Daneben bindet α-Hämolysin an ADAM10.[4]
Anwendung
Bearbeitenα-Hämolysin war ein frühes Untersuchungsobjekt bei der Entwicklung der Nanoporen-Sequenzierung.[8][9]
Literatur
Bearbeiten- P. A. Gurnev, E. M. Nestorovich: Channel-forming bacterial toxins in biosensing and macromolecule delivery. In: Toxins. Band 6, Nummer 8, August 2014, S. 2483–2540, doi:10.3390/toxins6082483, PMID 25153255, PMC 4147595 (freier Volltext).
Einzelnachweise
Bearbeiten- ↑ S. Bhakdi, J. Tranum-Jensen: Alpha-toxin of Staphylococcus aureus. In: Microbiological reviews. Band 55, Nummer 4, Dezember 1991, S. 733–751, PMID 1779933, PMC 372845 (freier Volltext).
- ↑ a b J. Bubeck Wardenburg, O. Schneewind: Vaccine protection against Staphylococcus aureus pneumonia. In: The Journal of experimental medicine. Band 205, Nummer 2, Februar 2008, S. 287–294, doi:10.1084/jem.20072208, PMID 18268041, PMC 2271014 (freier Volltext).
- ↑ J. Bubeck Wardenburg, T. Bae, M. Otto, F. R. Deleo, O. Schneewind: Poring over pores: alpha-hemolysin and Panton-Valentine leukocidin in Staphylococcus aureus pneumonia. In: Nature medicine. Band 13, Nummer 12, Dezember 2007, S. 1405–1406, doi:10.1038/nm1207-1405, PMID 18064027.
- ↑ a b B. J. Berube, J. Bubeck Wardenburg: Staphylococcus aureus α-toxin: nearly a century of intrigue. In: Toxins. Band 5, Nummer 6, Juni 2013, S. 1140–1166, PMID 23888516, PMC 3717774 (freier Volltext).
- ↑ a b L. Song, M. R. Hobaugh, C. Shustak, S. Cheley, H. Bayley, J. E. Gouaux: Structure of staphylococcal alpha-hemolysin, a heptameric transmembrane pore. In: Science. Band 274, Nummer 5294, Dezember 1996, S. 1859–1866, PMID 8943190.
- ↑ G. Menestrina, M. Dalla Serra, M. Comai, M. Coraiola, G. Viero, S. Werner, D. A. Colin, H. Monteil, G. Prévost: Ion channels and bacterial infection: the case of beta-barrel pore-forming protein toxins of Staphylococcus aureus. In: FEBS letters. Band 552, Nummer 1, September 2003, S. 54–60, PMID 12972152.
- ↑ H. Bantel, B. Sinha, W. Domschke, G. Peters, K. Schulze-Osthoff, R. U. Jänicke: alpha-Toxin is a mediator of Staphylococcus aureus-induced cell death and activates caspases via the intrinsic death pathway independently of death receptor signaling. In: Journal of Cell Biology. Band 155, Nummer 4, November 2001, S. 637–648, doi:10.1083/jcb.200105081, PMID 11696559, PMC 2198876 (freier Volltext).
- ↑ J. J. Kasianowicz, E. Brandin, D. Branton, D. W. Deamer: Characterization of individual polynucleotide molecules using a membrane channel. In: Proceedings of the National Academy of Sciences. Band 93, Nummer 24, November 1996, S. 13770–13773, PMID 8943010, PMC 19421 (freier Volltext).
- ↑ J. Nivala, D. B. Marks, M. Akeson: Unfoldase-mediated protein translocation through an α-hemolysin nanopore. In: Nature Biotechnology. Band 31, Nummer 3, März 2013, S. 247–250, doi:10.1038/nbt.2503, PMID 23376966, PMC 3772521 (freier Volltext).