1,4-Dioxan-2-on
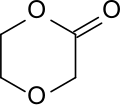
1,4-Dioxan-2-on (p-Dioxanon) ist das Lacton der 2-(2-Hydroxyethoxy)essigsäure und weist im Gegensatz zu dem isomeren 1,3-Dioxan-2-on – einem cyclischen Kohlensäureester (Carbonat) – eine intramolekulare Ester- und eine Ether-Funktion auf. Durch ringöffnende Polymerisation entsteht daraus Poly(p-dioxanon), das als bioabbaubares Implantatmaterial verwendet wird.[5]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 1,4-Dioxan-2-on | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C4H6O3 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 102,09 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest bzw. flüssig | |||||||||||||||
| Dichte |
1,39 g·cm−3[3] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Löslichkeit |
löslich in Aceton, Ethylacetat und Tetrahydrofuran[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Herstellung
BearbeitenDas gängige Verfahren zur Herstellung von 1,4-Dioxan-2-on ist die kontinuierliche Gasphasendehydrierung von Diethylenglycol an Kupfer- oder Kupferchromit-Katalysatoren bei Temperaturen bis 280 °C.
Dabei werden Ausbeuten bis 86 % erzielt.[6] Die möglichst vollständige Abtrennung des überschüssigen Diethylenglycols ist kritisch für die Eignung des p-Dioxanons als Monomer. Durch Umkristallisation, Vakuumdestillation[4] und Schmelzkristallisation[6] bzw. Kombination der Methoden werden die erforderlichen Reinheiten von >99,5 % erzielt.
Aus dem Mononatriumsalz des Ethylenglycols und Natriummonochloracetat wird das Natriumsalz der 2-(2-Hydroxyethoxy)essigsäure gebildet. Nach Ansäuern mit methanolischer Salzsäure, Einengen und Abtrennen des entstandenen Natriumchlorids wird bei der Vakuumdestillation p-Dioxanon in 67%iger Ausbeute erhalten.[7]
Eine weitere Alternative stellt die Oxidation von Methyldiglycol (2-(2-Methoxyethoxy)ethanol) zur 2-(2-Methoxyethoxy)essigsäure (3,6-Dioxaheptansäure) mit anschließender Etherspaltung an der endständigen Methoxygruppe dar. Die gebildete 2-(2-Hydroxyethoxy)essigsäure wird unter Wasserabspaltung zum Lacton p-Dioxanon cyclisiert.
Eigenschaften
BearbeitenReines 1,4-Dioxan-2-on ist ein weißer kristalliner Feststoff, der bei 28 °C[3] schmilzt. Bereits geringe Verunreinigungen führen zu einem bei Raumtemperatur flüssigen Material, das sich in einer Reihe von Lösungsmitteln (Ketonen, Estern, Ethern, Alkoholen) löst und z. B. aus Ethylacetat umkristallisiert werden kann.[8]
Anwendungen
BearbeitenBei der Oxidation von p-Dioxanon mit Salpetersäure oder Distickstofftetroxid entsteht in Ausbeuten bis 75 % Diglycolsäure.[9]
In einer ringöffnenden Polymerisation reagiert das Lacton 1,4-Dioxan-2-on unter Katalyse mit organischen Zinn-Verbindungen, wie z. B. Zinndioctoat (Zinn(II)-2-ethylhexanoat),[10] Dibutylzinndilaurat oder mit basischen Alkoxide, wie z. B. Aluminiumisopropoxid[11] zu Poly-1,4-Dioxan-2-on,
einem bioabbaubaren, teilkristallinen und thermolabilen Polymer für industrielle und medizinische Anwendungen.[5]
Bei Erhitzen über 100 °C tritt Depolymerisation zum Monomer p-Dioxanon ein.
Einzelnachweise
Bearbeiten- ↑ a b c d Eintrag zu 1,4-Dioxan-2-one bei TCI Europe, abgerufen am 30. März 2015.
- ↑ a b c Datenblatt 1,4-dioxan-2-one bei Sigma-Aldrich, abgerufen am 27. März 2015 (PDF).
- ↑ a b c S.-W. Lee, S.-I. Kim, S.-J. Park: Solubility and density of p-dioxanone in organic solvent systems. In: J. Korean Oil Chem. Soc. Band 25, Nr. 4, 2008, S. 429–437.
- ↑ a b Patent US2142033: Process for the production of 2-p-dioxanone. Angemeldet am 1. Juli 1936, veröffentlicht am 27. Dezember 1938, Anmelder: Carbide and Carbon Chemicals Corp., Erfinder: R.W. McNamee, C.M. Blair.
- ↑ a b R.S. Bezwada, D.D. Jamiolkowski, K. Cooper: Poly(p-dioxane) and its copolymers, in Handbook of Biodegradable Polymers. Hrsg.: A.J. Domb, J. Kost, D.M. Wiseman. Harwood Academic Publishers, 1997, ISBN 90-5702-153-6, Kap. 2, S. 29–61.
- ↑ a b Patent US5675022: Recovery of dioxanone by melt crystallization. Angemeldet am 23. August 1995, veröffentlicht am 7. Oktober 1997, Anmelder: Union Carbide Chemicals & Plastics Technology Corp., Erfinder: C.G. Moyers, M.P. Farr.
- ↑ Patent EP1138664A2: Purified salt of β-hydroxyethoxy acetic acid, 2-p-dioxanone, and manufacturing method thereof. Angemeldet am 30. März 2001, veröffentlicht am 4. Oktober 2001, Anmelder: Mitsui Chemicals, Inc., Erfinder: S. Nakatani, T. Matsumoto, Y. Nakahara, H. Akieda, T. Ishitoku.
- ↑ Patent US5391768: Purification of 1,4-dioxan-2-one by crystallization. Angemeldet am 25. März 1993, veröffentlicht am 21. Februar 1995, Anmelder: United States Surgical Corp., Erfinder: Y. Jiang.
- ↑ Patent US3952054: Process for preparing diglycolic acid. Angemeldet am 5. Dezember 1974, veröffentlicht am 20. April 1976, Anmelder: Monsanto Co., Erfinder: C.Y. Shen.
- ↑ Patent US3645941: Method of preparing 2-p-dioxanone polymers. Angemeldet am 1. April 1970, veröffentlicht am 29. Februar 1972, Anmelder: Eastman Kodak Co., Erfinder: T.C. Snapp, A.E. Blood.
- ↑ Jean-Marie Raquez, Philippe Degée, Ramani Narayan, Philippe Dubois: Some Thermodynamic, Kinetic, and Mechanistic Aspects of the Ring-Opening Polymerization of 1,4-Dioxan-2-one Initiated by Al(OiPr)3 in Bulk. In: Macromolecules. Band 34, Nr. 24, Oktober 2001, S. 8419–8425, doi:10.1021/ma010396e.

