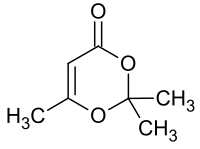
2,2,6-Trimethyl-4H-1,3-dioxin-4-on
2,2,6-Trimethyl-4H-1,3-dioxin-4-on ist ein sechsgliedriger Heterocyclus mit zwei Sauerstoffatomen in 1,3-Stellung mit dem Grundgerüst des 1,3-Dioxans. Die Verbindung stellt das 1:1-Addukt aus Diketen und Aceton dar und dient in chemischen Synthesen als Äquivalent des giftigen, übelriechenden und tränenreizenden Diketens. Diketen-Aceton-Addukt (DAA) zerfällt beim Erhitzen in Acetylketen, das mit Nukleophilen eine Vielzahl von Acetessigsäure-Derivaten bilden kann.[3]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2,2,6-Trimethyl-4H-1,3-dioxin-4-on | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C7H10O3 | ||||||||||||||||||
| Kurzbeschreibung |
klare, braune Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 142,16 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser, mischbar mit den meisten organischen Lösungsmitteln[3] | ||||||||||||||||||
| Brechungsindex |
1,4678 (25 °C, 589 nm)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen und Darstellung
BearbeitenSynthese, Struktur und Eigenschaften von 2,2,6-Trimethyl-4H-1,3-dioxin-4-on wurden erstmals eindeutig und umfassend im Jahr 1952 von M.F. Carroll und Alfred Bader beschrieben.[4][5]
Diketen reagiert mit Aceton bei 90 °C in Gegenwart katalytischer Mengen von p-Toluolsulfonsäure in 91%iger Ausbeute zu DAA. Die Reaktion kann auch durch quartäre Ammoniumverbindungen katalysiert werden.[6]
Substituierte 2,2-Dimethyl-1,3-dioxin-4-one entstehen bei der Reaktion von β-Ketosäuren mit Aceton.[7]
Eigenschaften
Bearbeiten2,2,6-Trimethyl-4H-1,3-dioxin-4-on ist eine entzündliche, gelbbraune Flüssigkeit mit angenehmem Geruch.[4] Die Verbindung ist praktisch unlöslich in Wasser und mischt sich mit den meisten organischen Lösungsmitteln. Technisches DAA enthält meist noch geringe Mengen (meist bis 6 %) Aceton. Wegen der Zersetzung bei höheren Temperaturen muss die Reinigung des Diketen-Aceton-Addukts durch fraktionierte Destillation bei < 80 °C erfolgen.
Anwendungen
BearbeitenReaktionen an DAA
BearbeitenMit Chlor in Dichlormethan wird das Diketen-Aceton-Addukt bei −50 °C in 5-Stellung in quantitativer Ausbeute zur Chlormethylverbindung umgesetzt.[8]
Das 5-Chlormethylderivat reagiert mit Natriummethanolat glatt (94 % Ausbeute) zu Methyl-α-Chloracetoacetat.
Chlor kann an der aktivierten Methylgruppe in 6-Stellung nach Reaktion mit Lithiumdiisopropylamid LDA in THF mit Hexachlorethan eingeführt werden.[9]
Aus der Chlormethylverbindung wird mit dem Kaliumsalz des Diethylphosphits die entsprechende Phosphonoalkylverbindung erhalten, die bei der Thermolyse in Gegenwart von z. B. Aminosäureestern β-Ketosäureamide bildet.
Diese β-Ketosäureamide lassen sich leicht mit Natriummethanolat zu ungesättigten Tetramsäuren cyclisieren.
Bei der Umsetzung von 2,2,6-Trimethyl-4H-1,3-dioxin-4-on mit α,ω-Diaminen durch einfaches Erhitzen auf 130 °C für 5 Minuten unter Mikrowellenbestrahlung werden die schwierig zugänglichen „mittleren Ringe“ mit 7–10 Ringgliedern in quantitativer Ausbeute erhalten.[10]
Reaktionen mit Acetylketen
BearbeitenDurch thermische Retro-Diels-Alder-Reaktion bei Temperaturen über 100 °C entsteht aus 2,2,6-Trimethyl-4H-1,3-dioxin-4-on das reaktive Acetylketen, das bei Temperaturen > 130 °C in Xylol in einer [4+2]-Cycloaddition praktisch quantitativ zu Dehydracetsäure dimerisiert.[11]
Dehydracetsäure wurde bereits 1953 in 51%iger Ausbeute beim Erhitzen von Diketen-Aceton-Addukt in Toluol in Gegenwart der schwachen Base Calciumacetat erhalten[5], ohne dass Acetylketen als reaktive Zwischenstufe erkannt wurde.
Acetylketen reagiert in situ mit Nukleophilen, wie z. B. Alkoholen, Phenolen, Thiolen und Aminen in hohen Ausbeuten zu Derivaten der Acetessigsäure.[5][12]
Nebenreaktionen bei der Reaktion mit Alkoholen und Aminen werden unterdrückt, wenn die Umsetzung mit 2,2,6-Trimethyl-4H-1,3-dioxin-4-on in Tetrahydrofuran unter Rückfluss in Gegenwart stöchiometrischer Mengen von Natriumacetat durchgeführt wird.[13]
Auch mit sterisch gehinderten Nukleophilen können praktisch quantitative Umsätze erzielt werden.
In einer Hetero-Diels-Alder-Reaktion ([4+2]-Cycloaddition) werden mit Dienophilen der Struktur X=Y sechsgliedrige Heterocyclen mit einer Kohlenstoff-Kohlenstoff-Doppelbindung gebildet.[14]
Die Biginelli-Reaktion als Mehrkomponentenreaktion im Eintopfverfahren liefert auch in siedendem Wasser als Lösungsmittel mit 2,2,6-Trimethyl-4H-1,3-dioxin-4-on und Anilin das N-Phenylacetoacetanilid (94 % Ausbeute), das in Ethanol mit Harnstoff und dem Aldehyd Piperonal mit 86%iger Ausbeute zum entsprechenden Dihydropyrimidinderivat reagiert.[15]
3,4-Dihydropyrimidin-2(1H)-one (DHPMs) liegen einer Vielzahl von pharmakologisch aktiven Substanzen zugrunde.
Einzelnachweise
Bearbeiten- ↑ a b c Datenblatt 2,2,6-Trimethyl-4H-1,3-dioxin-4-one bei Sigma-Aldrich, abgerufen am 20. Dezember 2019 (PDF).
- ↑ a b c d e W.L.F. Armarego, C.L.L. Chai: Purification of Laboratory Chemicals, 7th Edition. Elsevier Inc., Amsterdam 2013, ISBN 978-0-12-382161-4, S. 493.
- ↑ a b R.J. Clemens: 2,2,6-Trimethyl-4H-1,3-dioxin-4-one. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2001, doi:10.1002/047084289X.rt272.
- ↑ a b M.F. Carroll, A.R. Bader: The reaction of diketene with ketones. In: J. Am. Chem. Soc. Band 74, Nr. 24, 1952, S. 6305, doi:10.1021/ja01144a530.
- ↑ a b c M.F. Carroll, A.R. Bader: The reactions of diketene with ketones. In: J. Am. Chem. Soc. Band 75, Nr. 21, 1953, S. 5400–5402, doi:10.1021/ja01117a076.
- ↑ E.V. Dehmlow, A.R. Shamout: Oniumsalz-katalysierte Umsetzungen von Carbonylverbindungen mit Diketen. In: Justus Liebigs Ann. Chem. Band 1982, Nr. 9, 1952, S. 1753–1755, doi:10.1002/jlac.198219820917.
- ↑ M. Sato, H. Ogasawara, K. Oi, T. Kato: Synthesis of 1,3-Dioxin-4-one derivatives. In: Chem. Pharm. Bull. Band 31, Nr. 6, 1983, S. 1896–1901, doi:10.1248/cpb.31.1896.
- ↑ Patent US4633013: Preparation of α-haloacetoacetic acid esters. Angemeldet am 11. Juni 1984, veröffentlicht am 30. Dezember 1986, Anmelder: Eastman Kodak Co., Erfinder: R.J. Clemens.
- ↑ R.K. Boeckman, Jr., R.B. Perni, J.E. Macdonald, A.J. Thomas: 6-Diethylphosphonomethyl-2,2-dimethyl-1,3-dioxen-4-one In: Organic Syntheses. 66, 1988, S. 194, doi:10.15227/orgsyn.066.00194; Coll. Vol. 8, 1993, S. 192 (PDF).
- ↑ C.S. Morrison, J.B. Lampe, T.C. Kolodziejczyk, R.J. Cavazos, R.A. Petros: Rapid, quantitative, solvent-free synthesis of medium-ring diaza heterocycles from diketene–acetone adduct and diamines. In: Tetrahedron Lett. Band 55, Nr. 48, 2014, S. 6547–6549, doi:10.1016/j.tetlet.2014.10.007.
- ↑ Patent US4496747: Process for the preparation of dehydracetic acid. Angemeldet am 21. April 1983, veröffentlicht am 29. Januar 1985, Anmelder: Eastman Kodak Co., Erfinder: R.J. Clemens.
- ↑ R.J. Clemens, J.A. Hyatt: Acetoacetylation with 2,2,6-Trimethyl-4H-1,3-dioxin-4-one: A convenient alternative to diketene. In: J. Org. Chem. Band 50, Nr. 14, 1985, S. 2431–2435, doi:10.1021/jo000214a006.
- ↑ V. Sridharan, M. Ruiz, J.C. Menéndez: Mild and high-yielding synthesis of β-keto esters and β-ketoamides. In: Synthesis. Band 2010, Nr. 6, 2010, S. 1053–1057, doi:10.1055/s-0029-1217135.
- ↑ G. Jäger, J. Wenzelburger: Acylketene II1), Heterocyclensynthesen durch Cycloadditionen mit Acylketenen. In: Justus Liebigs Ann. Chem. Band 1976, Nr. 9, 1976, S. 1689–1712, doi:10.1002/jlac.197619760917.
- ↑ F.H.S. Gama, R.O.M.A. de Souza, S.J. Garden: An efficient green protocol for the preparation of acetoacetamides and application of the methodology to a one-pot synthesis of Biginelli dihydropyrimidines. Expansion of dihydropyrimidine topological chemical space. In: RSC Adv. Band 5, Nr. 87, 2015, S. 70915–70928, doi:10.1039/C5RA14355A.

