2-Hydroxypropanal
2-Hydroxypropanal (Trivialname Lactaldehyd) ist eine chemische Verbindung aus der Reihe der Hydroxyaldehyde. Die Synthese und Eigenschaften der Verbindung wurden erstmals 1908 von Alfred Wohl beschrieben.[1]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
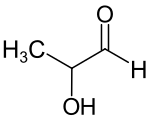
| ||||||||||||||||||||||
| Strukturformel ohne Stereochemie | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | 2-Hydroxypropanal | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C3H6O2 | |||||||||||||||||||||
| Kurzbeschreibung |
geruchloser Feststoff mit schwach bitterem Geschmack[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 74,08 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||||||||
| Schmelzpunkt |
105 °C[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Isomere
Bearbeiten2-Hydroxypropanal ist chiral, es bildet aufgrund des Stereozentrums am α-C-Atom zwei Enantiomere aus, die als (2R)- und (2S)-2-Hydroxypropanal [Synonyme: D-(−)- und L-(+)-2-Hydroxypropanal] bezeichnet werden.
| Isomere von 2-Hydroxypropanal | ||
| Name | (2S)-2-Hydroxypropanal | (2R)-2-Hydroxypropanal |
| Andere Namen | L-Lactaldehyd (+)-Lactaldehyd |
D-Lactaldehyd (−)-Lactaldehyd |
| Strukturformel | ||
| CAS-Nummer | 3913-64-2 | 3946-09-6 |
| 598-35-6 (Racemat) | ||
| EG-Nummer | – | – |
| 809-415-9 (Racemat) | ||
| ECHA-Infocard | – | – |
| 100.237.284 (Racemat) | ||
| PubChem | 439231 | 439350 |
| 855 (Racemat) | ||
| DrugBank | DB03776 | – |
| – (Racemat) | ||
| Wikidata | Q28529704 | Q27102246 |
| Q4381828 (Racemat) | ||
Synthese
BearbeitenBei der Erstsynthese wird das Calciumsalz der Glyoxylsäure 1 mit Ethanol und Salzsäure zum Diethoxyessigsäureethylester 2 verestert und acetalisiert. Diese Zwischenstufe wird anschließend mit Piperidin zum Carbonsäureamid 3 umgesetzt. Die Grignard-Reaktion des Piperidids mit Methylmagnesiumiodid ergibt das Keton 4 – das Aldehydacetal des Methylglyoxals. Dieses Keton lässt sich mit Natrium in Ethanol zu dem Acetal des 2-Hydroxypropanal 5 reduzieren. Das Acetal wird abschließend mit verdünnter Schwefelsäure zum 2-Hydroxypropanal 6 verseift.[3]
In einer alternativen Synthese, 1935 von Hermann Otto Laurenz Fischer und Erich Baer beschrieben, wird Diethoxyacetaldehyd[4] 7 in einer Grignard-Reaktion mit Methylmagnesiumiodid zum 2-Hydroxypropanaldiethylacetal 8 umgesetzt und anschließend zum 2-Hydroxypropanal 6 verseift.[5]
1952 wurde von John Kenyon Netherton Jones ein weiterer synthetischer Zugang zu 2-Hydroxypropanal veröffentlicht. Dabei wird die Aldehydgruppe von Methylglyoxal 9 mit Butanol und p-Toluolsulfonsäure (pTsOH) als Katalysator selektiv in das Dibutylacetal 10 überführt. Die Reduktion mit Lithiumaluminiumhydrid in Ether führt zum 2-Hydroxypropanaldibutylacetal 11, das im abschließenden Schritt in einem Gemisch von Eisessig, Wasser und Ameisensäure zum 2-Hydroxypropanal 6 hydrolysiert wird.[6]
Eigenschaften
BearbeitenBereits Wohl konnte zeigen, dass 2-Hydroxypropanal in einer frisch bereiteten wässrigen Lösung als Dimer vorliegt und langsam in die monomolekulare Form übergeht.[1] Dieses Verhalten wurde 1982 durch NMR-, Raman- und Infrarotspektroskopie bestätigt und im Detail untersucht.[7] Durch Umkristallisation aus verschiedenen Lösungsmitteln kann man drei Kristallformen isolieren, bei denen es sich um Konfigurationsisomere von 3,6-Dimethyl-1,4-dioxan-2,5-diol – ein cyclisches Halbacetal mit einer 1,4-Dioxan-Grundstruktur – handelt. Diese entstehen durch die Dimerisierung des offenkettigen DL-2-Hydroxypropanal:
In einer DMSO-d6-Lösung erhält man aus den drei verschiedenen Kristallformen nach einiger Zeit ein identisches 1H-NMR-Spektrum, das sich aus der Überlagerung der Spektren der Konfigurationsisomeren 2, 3 und 4 ergibt:
Somit stehen diese Konfigurationsisomere über das 2-Hydroxypropanal 1 miteinander im Gleichgewicht. Die Anteile der drei Spezies 2, 3 und 4 im Gleichgewichtsgemisch betragen 53,6 %, 38,6 % und 7,8 %. Die Geschwindigkeit der Gleichgewichtseinstellung ist sehr unterschiedlich. Ausgehend von Isomer 4 stellt sich das Gleichgewicht in Lösung nach etwa einem Monat ein, während ausgehend von Isomer 3 das Gleichgewicht in zwei bis drei Tagen erreicht wird.
Die drei dimeren Formen des 2-Hydroxypropanal entstehen jeweils durch die Reaktion eines D- und eines L-Monomers. Die Dimere aus zwei D- oder zwei L-Monomeren werden nicht beobachtet.
Im NMR-Spektrum der Gleichgewichtsmischung erhält man zusätzlich schwache Signale, die man einem Fünfring-Dimer zuordnen kann, sowie ein sehr schwaches Signal für das Aldehyproton des Monomers.
Einzelnachweise
Bearbeiten- ↑ a b c d e A. Wohl: Zur Kenntnis der Dreikohlenstoffreihe. In: Berichte der deutschen chemischen Gesellschaft. Band 41, Nr. 3, Oktober 1908, S. 3599, doi:10.1002/cber.19080410340.
- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von [No public or meaningful name is available] im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 6. Juli 2020.
- ↑ A. Wohl, M. Lange: Aufbau des Milchsäurealdehyds. In: Berichte der deutschen chemischen Gesellschaft. Band 41, Nr. 3, Oktober 1908, S. 3612, doi:10.1002/cber.19080410341.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Diethoxyacetaldehyd: CAS-Nr.: 5344-23-0, EG-Nr.: 807-284-2, ECHA-InfoCard: 100.234.849, PubChem: 219609, ChemSpider: 190379, Wikidata: Q82950805.
- ↑ Hermann O. L. Fischer, Erich Baer: Über Glyoxal-semiacetal. (II. Mitteilung über Glyoxal). In: Helvetica Chimica Acta. Band 18, Nr. 1, 1935, S. 514, doi:10.1002/hlca.19350180169.
- ↑ L. Hough, J. K. N. Jones: 773. The synthesis of sugars from simpler substances. Part IV. Enzymic synthesis of 6-deoxy-D-fructose and 6-deoxy-L-sorbose. In: Journal of the Chemical Society. 1952, S. 4052, doi:10.1039/jr9520004052.
- ↑ Hiroaki Takahashi, Yoko Kobayashi, Norio Kaneko: Conformational studies of DL-lactaldehyde by 1H-NMR, Raman and i.r. spectroscopy. In: Spectrochimica Acta Part A: Molecular Spectroscopy. Band 39, Nr. 6, Januar 1983, S. 569, doi:10.1016/0584-8539(83)80108-1.
