5-Aminobenzimidazolon
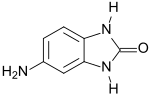
5-Aminobenzimidazolon (Aminolon) ist ein Benzimidazolon, das in 5-Stellung eine Aminogruppe trägt. Aminolon ist ein essentieller Molekülbaustein (engl. building block) für gelbe, orange, rote, violette und bordeauxfarben-braune Benzimidazolonpigmente, die sich durch hohe Lichtechtheit, Witterungs- und Lösungsmittelbeständigkeit sowie thermische und chemische Stabilität auszeichnen.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 5-Aminobenzimidazolon | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C7H7N3O | ||||||||||||||||||
| Kurzbeschreibung |
weißes bis blassviolettes Kristallpulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 149,15 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in kaltem, wenig löslich in heißem Wasser (ca. 30 g·l−1 bei 83 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Darstellung
BearbeitenWegen der geringen Löslichkeit von 5-Aminobenzimidazol-2-on in gängigen Lösungsmitteln zur Umkristallisation und der hohen Reinheitsanforderungen an Pigmentvorstufen eignen sich nur solche Synthesewege, die unmittelbar zu einem hochreinen Produkt führen.
In der Patentliteratur ist eine Syntheseroute angegeben, die von 2,4-Dinitrochlorbenzol ausgeht, das mit Cyanamid zum entsprechenden Cyanamidderivat und weiter mit Wasser zu 2,4-Dinitrophenylharnstoff reagiert.[5]
2,4-Dinitrophenylharnstoff wird unter definierten Bedingungen an einem Nickel-Kontakt zum Diamin hydriert und unter Ammoniakabspaltung zum 1,3-Dihydro-2H-benzimidazol-2-on cyclisiert.[2] Die Gesamtausbeute der Reaktionsfolge beträgt ca. 81 %.
Die gängige Synthesevariante startet mit Benzimidazolon (aus 1,2-Phenylendiamin und Harnstoff[6]), das mit Salpetersäure zum so genannten Nitrolon nitriert[7] und anschließend mit einem Nickelkatalysator zu Aminolon hydriert wird.[8][9]
Eine weitere kostengünstige Synthese geht von 5-Nitro-o-phenylendiamin[10] aus. Die Umsetzung mit Phosgen ergibt das 5-Nitrobenzimidazolon, das zum 5-Aminobenzimidazolon reduziert wird.[11]
Eigenschaften
Bearbeiten5-Aminobenzimidazolon ist ein weißer kristalliner Feststoff, der sich in Wasser praktisch nicht löst. Besser löslich ist das Amin in heißem Wasser und in Alkohol/Wasser-Gemischen bei erhöhter Temperatur, wie z. B. in heißem 50%igem Ethanol (ca. 120 g·l-1 bei 83 °C).[3]
Anwendungen
BearbeitenDie wesentliche Anwendung für Aminobenzimidazolon ist als Ausgangsstoff für Pigmente aus der Stoffklasse der Benzimidazolone, die ein breites Farbspektrum von gelb bis braun abdecken.
Stammverbindung von gelb bis orange gefärbten Benzimidazolonpigmenten ist das 5-Acetoacetylaminobenzimidazolon[12], das durch Reaktion von 5-Aminobenzimidazol-2-on mit Diketen erhalten werden kann.[3] Das auch als Acetolon bezeichnete farblose Zwischenprodukt kann mit Diazoniumsalzen, wie z. B. durch Diazotierung von 2-Aminobenzotrifluorid, zu dem grünlich gelbem Azopigment Pigment Yellow 154 (P.Y. 154, Hostaperm®H3G) umgesetzt werden.
Pigmente auf Basis von 5-Aminobenzimidazol-2-on sind relativ teure, aber aufgrund ihres vorteilhaften Eigenschaftsprofils auch im Vergleich zu Chinacridonen, Perylenen oder Diketopyrrolopyrrolen wettbewerbsfähige Hochleistungspigmente.
Einzelnachweise
Bearbeiten- ↑ Eintrag zu 5-Amino-2-benzimidazolinone bei TCI Europe, abgerufen am 12. Januar 2021.
- ↑ a b Patent EP0012983: Diaminophenylharnstoffe, Verfahren zur Herstellung und ihre Verwendung zur Herstellung von Aminobenzimidazolonen-(2). Angemeldet am 9. Juli 1980, veröffentlicht am 18. Dezember 1979, Anmelder: Hoechst AG, Erfinder: O. Arndt, T. Papenfuhs, P. Böhme, W. Tronich, B. Mees.
- ↑ a b c Patent US5476948: Preparation of 5-acetoacetylamino-2-benzimidazolone. Angemeldet am 19. Oktober 1994, veröffentlicht am 19. Dezember 1995, Anmelder: Hoechst AG, Erfinder: K.E. Mack, M. Bohusch.
- ↑ a b Datenblatt 5-Amino-1,3-Dihydro-2H-Benzimidazol-2-One bei Sigma-Aldrich, abgerufen am 12. Januar 2021 (PDF).
- ↑ Patent EP0012981A1: Verfahren zur Herstellung von 2,4-Dinitrophenyl-harnstoff. Angemeldet am 18. Dezember 1979, veröffentlicht am 9. Juli 1980, Anmelder: Hoechst AG, Erfinder: T. Papenfuhs, K. Gengnagel.
- ↑ Patent US4269989: Process for the preparation of benzimidazolone-(2). Angemeldet am 19. Dezember 1979, veröffentlicht am 26. Mai 1981, Anmelder: Hoechst AG, Erfinder: H. Heise, E. Hille, R. Wagner, K. Kümmerle.
- ↑ Patent EP0014449A2: Verfahren zur Herstellung von 5-Nitrobenzimidazolon-(2). Angemeldet am 4. Februar 1979, veröffentlicht am 20. August 1980, Anmelder: Hoechst AG, Erfinder: B. Mees, J. Ribka.
- ↑ H. Schindlbauer, W. Kwiecinski: Zur direkten Nitrierung des Benzimidazolons und der Reduktion einiger dieser Nitrierungsprodukte. In: Monatsh. Chem. Band 107, Nr. 6, 1976, S. 1307–1310, doi:10.1007/BF01153908.
- ↑ Patent EP0023260A1: 5-Amino-benzimidazol-2-on-Hydrat, Verfahren zu seiner Herstellung und seine Verwendung als Farbenvorprodukt. Angemeldet am 18. Juni 1980, veröffentlicht am 4. Februar 1981, Anmelder: Hoechst AG, Erfinder: O. Arndt, R. Lemberg.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 4-Nitro-o-phenylendiamin: CAS-Nr.: 99-56-9, EG-Nr.: 202-766-3, ECHA-InfoCard: 100.002.515, GESTIS: 570051, PubChem: 5111791, ChemSpider: 4286892, Wikidata: Q5649571.
- ↑ Willy Herbst, Klaus Hunger: Industrielle Organische Pigmente. Herstellung, Eigenschaften, Anwendung. VCH Verlagsgesellschaft, Weinheim 1995, ISBN 3-527-28744-2, S. 356 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 5-Acetoacetylaminobenzimidazolon: CAS-Nr.: 26576-46-5, EG-Nr.: 247-820-7, ECHA-InfoCard: 100.043.458, PubChem: 117822, ChemSpider: 105286, Wikidata: Q27275257.
