6,7-Dimethoxycumarin
6,7-Dimethoxycumarin, mit Trivialnamen Scoparon, ist eine chemische Verbindung aus er Gruppe der Cumarine, die eine antioxidative Wirkung hat.[4]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
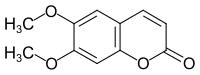
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 6,7-Dimethoxycumarin | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C11H10O4 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 192,17 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Vorkommen
Bearbeiten6,7-Dimethoxycumarin kommt in verschiedenen Artemisia-Arten, wie Besen-Beifuß (Artemisia scoparia),[4] Einjährigem Beifuß (Artemisia annua),[3] und Estragon (Artemisia dracunculus),[3] in Zitrusfrüchten, wie Zitronen (Citrus limon),[3] Orangen (Citrus sinensis)[3] und Mandarinen (Citrus reticulata),[3] sowie in Sellerie (Apium graveolens),[3] Fenchel (Foeniculum vulgare),[3] Anis (Pimpinella anisum),[3] Büschel-Rosen (Rosa multiflora),[3] Kudzu (Pueraria montana)[3] und Fieberklee (Menyanthes trifoliata)[3] vor.
-
Besen-Beifuß
-
Zitronen
-
Sellerie
-
Fenchel
Wirkung
BearbeitenEs wurde eine Vielzahl von pharmakologischen Effekten von 6,7-Dimethoxycumarin beschrieben,[5] darunter auch die Wirkung als Akarizid. Der Wirkmechanismus beruht dabei auf der Hemmung der Expression von Vitellogenin.[6] Die Milben werden durch Auslösung der Spannungsabhängigen L-Typ-Calciumkanäle (L-VGCC) getötet.[7]
Eine Bestrahlung mit UV-Licht erhöht die Produktion von phytoalexinem 6,7-Dimethoxycumarin in Zitrusfrüchten, was diese vor Fruchtfäulen schützt.[8]
Metabolismus
Bearbeiten6,7-Dimethoxycumarin wird per 6-O-, seltener 7-O-Demethylierung, zu Isoscopoletin bzw. Scopoletin abgebaut. Der weitere Abbau führt zu Esculetin.[9]
Darstellung
BearbeitenDie Aufreinigung kann über verschiedene Methoden erfolgen.[10]
Einzelnachweise
Bearbeiten- ↑ Eintrag zu SCOPARONE in der CosIng-Datenbank der EU-Kommission, abgerufen am 3. September 2021.
- ↑ a b c d e Datenblatt Scoparon bei Sigma-Aldrich, abgerufen am 3. August 2021 (PDF).
- ↑ a b c d e f g h i j k l m SCOPARONE (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 8. September 2021.
- ↑ a b Paul Sourivong, Kristina Schronerová, Melánia Babincová: Scoparone Inhibits Ultraviolet Radiation-Induced Lipid Peroxidation. In: Zeitschrift für Naturforschung C. 62, 2007, S. 61–64 (PDF, freier Volltext).
- ↑ Yangyang Hui, Xiaoyu Wang, Zihan Yu, Xiaofei Fan, Binxin Cui, Tianming Zhao, Lihong Mao, Hongjuan Feng, Lin Lin, Qingxiang Yu, Jie Zhang, Bangmao Wang, Xin Chen, Xingliang Zhao, Chao Sun: Scoparone as a therapeutic drug in liver diseases: Pharmacology, pharmacokinetics and molecular mechanisms of action. In: Pharmacological Research. Band 160, 2020, S. 105170, doi:10.1016/j.phrs.2020.105170.
- ↑ Hong Zhou, Jinlin Liu, Fenglin Wan, Fuyou Guo, Yeshuang Ning: Insight into the mechanism of action of scoparone inhibiting egg development of Tetranychus cinnabarinus Boisduval. In: Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology. Band 246, August 2021, S. 109055, doi:10.1016/j.cbpc.2021.109055.
- ↑ Hong Zhou, Fenglin Wan, Fuyou Guo, Jinlin Liu, Wei Ding: High value-added application of a renewable bioresource as acaricide: investigation the mechanism of action of scoparone against Tetranychus cinnabarinus. In: Journal of Advanced Research. August 2021, S. S2090123221001661, doi:10.1016/j.jare.2021.08.013.
- ↑ Ittetsu Yamaga, Shigekazu Nakamura: Blue LED Irradiation Induces Scoparone Production in Wounded Satsuma Mandarin ‘Aoshima Unshu’ and Reduces Fruit Decay during Long-term Storage. In: The Horticulture Journal. Band 87, Nr. 4, 2018, S. 474–480, doi:10.2503/hortj.OKD-147.
- ↑ Risto Juvonen, Filip Novák, Eleni Emmanouilidou, Seppo Auriola, Juri Timonen: Metabolism of Scoparone in Experimental Animals and Humans. In: Planta Medica. Band 85, Nr. 06, April 2019, S. 453–464, doi:10.1055/a-0835-2301.
- ↑ C. H. Ma, W. Ke, Z. L. Sun, J. Y. Peng, Z. X. Li: Large-Scale Isolation and Purification of Scoparone from Herba artemisiae scopariae by High-Speed Counter-Current Chromatography. In: Chromatographia. Band 64, Nr. 1–2, Juli 2006, S. 83–87, doi:10.1365/s10337-006-0789-7.
