Agaritin
Agaritin ist ein strukturell vom Phenylhydrazin abgeleiteter Naturstoff, der in verschiedenen Pilzarten vorkommt.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
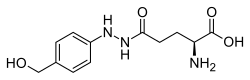
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Agaritin | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C12H17N3O4 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 267,28 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Vorkommen
BearbeitenAgaritin kommt in mindestens 53 Arten der Gattung Agaricus vor, darunter im Zucht-Champignon (Agaricus bisporus).[2][3] Der Gehalt in frischen Zuchtchampignons beträgt etwa 94–629 mg/kg, während der Gehalt in verarbeiteten Pilzen geringer ist. Der Gehalt hängt auch von der spezifischen Pilzsorte und den Umgebungsbedingungen ab.[2] Einige Agaricus-Arten erhalten deutlich höhere Gehalte an Agaritin als der Zuchtchampignon: In Agaricus elevensis wurden Mengen von über 10 g/kg nachgewiesen.[3]
Synthese
BearbeitenMehrere Totalsynthesen von Agaritin wurden veröffentlicht. In einer Synthese war das Edukt ein Derivat der Glutaminsäure mit einem Carbonsäureazid in γ-Position und einer Cbz-Schutzgruppe an der Aminogruppe.[4] Eine neuere Synthese geht ebenfalls von einem Glutaminsäurederivat aus, das allerdings an der Aminogruppe und der α-Carboxylgruppe Cbz-geschützt ist. Die Aktivierung erfolgt in situ mit DCC.[5]
Eigenschaften
BearbeitenDie Verbindung ist mäßig stabil und zersetzt sich in Lösung mit der Zeit, insbesondere unter Einfluss von Sauerstoff (Spülen der Lösung mit Stickstoff oder Zusatz des Antioxidationsmittels Dithiothreitol verlangsamen die Zersetzung). Beim Trocknen, Kochen oder Einfrieren von Pilzen wird Agaritin ebenfalls zum Teil zersetzt.[2]
Es gibt widersprüchliche Studien zur Frage, ob Agaritin cancerogen oder mutagen ist. Allerdings gibt es keine Studie, die darauf hindeutet, dass die aufgenommene Menge an Agaritin beim Verzehr von Speisepilzen einen relevanten toxikologischen Effekt hat.[2]
Agaritin inhibiert Polyphenoloxidasen, die für die Braunverfärbung von Pilzen, Obst und Gemüse verantwortlich sind, und baut Chinone ab, die durch solche Enzyme gebildet werden. Daher wird angenommen, dass Agaritin ein Regulator für diese Enzyme beziehungsweise den Bräunungsprozess ist.[6] Die Verbindung inhibiert auch die HIV-Protease.[7]
Verwendung
BearbeitenDurch seine Inhibierung von Polyphenoloxidasen könnte es ein Ausgangspunkt für Produkte sein, die Verfärbung von Nahrungsmitteln (z. B. geschnittenem Obst) verhindern.[6] Es wurde als Ausgangspunkt für die Entwicklung von HIV-Protease-Inhibitoren verwendet.[7]
Einzelnachweise
Bearbeiten- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b c d Peter Roupas, Jennifer Keogh, Manny Noakes, Christine Margetts, Pennie Taylor: Mushrooms and agaritine: A mini-review. In: Journal of Functional Foods. Band 2, Nr. 2, April 2010, S. 91–98, doi:10.1016/j.jff.2010.04.003.
- ↑ a b V. Schulzová, J. Hajslova, R. Peroutka, J. Hlavasek, J. Gry, H.C. Andersson: Agaritine content of 53 Agaricus species collected from nature. In: Food Additives & Contaminants: Part A. Band 26, Nr. 1, Januar 2009, S. 82–93, doi:10.1080/02652030802039903.
- ↑ R. B. Kelly, E. G. Daniels, J. W. Hinman: Agaritine: Isolation, Degradation, and Synthesis. In: The Journal of Organic Chemistry. Band 27, Nr. 9, September 1962, S. 3229–3231, doi:10.1021/jo01056a057.
- ↑ Subir Datta, Lienhard Hoesch: Novel Synthesis of Agaritine, a 4-Hydrazinobenzyl-Alcohol Derivative Occurring in Agaricaceae. In: Helvetica Chimica Acta. Band 70, Nr. 5, 12. August 1987, S. 1261–1267, doi:10.1002/hlca.19870700505.
- ↑ a b Juan Carlos Espín, Sylvie Jolivet, Harry J. Wichers: Inhibition of Mushroom Polyphenol Oxidase by Agaritine. In: Journal of Agricultural and Food Chemistry. Band 46, Nr. 8, 17. August 1998, S. 2976–2980, doi:10.1021/jf9802732.
- ↑ a b Wei-Na Gao, Dong-Qing Wei, Yun Li, Hui Gao, Wei-Ren Xu, Ai-Xiu Li, Kuo-Chen Chou: Agaritine and Its Derivatives Are Potential Inhibitors against HIV Proteases. In: Medicinal Chemistry. Band 3, Nr. 3, S. 221–226, doi:10.2174/157340607780620644.