Ammoniumiodat
Ammoniumiodat ist das Ammoniumsalz der Iodsäure. Es ist ein weißes, in Wasser schwer lösliches Salz, das – wie alle Iodate – oxidierend wirkt.[3]
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
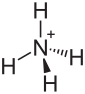 
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Ammoniumiodat | ||||||||||||
| Summenformel | NH4IO3 | ||||||||||||
| Kurzbeschreibung |
farb- und geruchloser Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 192,94 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Dichte |
3,309 g·cm−3[1] | ||||||||||||
| Schmelzpunkt |
Zersetzung ab 150 °C[2] | ||||||||||||
| Löslichkeit |
20,6 g·l−1 bei 20 °C[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Herstellung
BearbeitenAmmoniumiodat kann durch die Neutralisation von Iodsäure mit Ammoniak hergestellt werden.[2]
Es kann auch mit einem Ammoniumsalz aus einer Iodatlösung ausgefällt werden.
Eigenschaften
BearbeitenAmmoniumiodat löst sich schlecht in kaltem, und mäßig in warmem Wasser. Es enthält ein oxidierendes Anion und ein reduzierendes Kation, daher zersetzt es sich schon bei 150 °C zu Stickstoff, Sauerstoff, Iod und Wasser.
Ab 60 °C kann sich die Reaktion ohne äußere Hitzequelle aufrechterhalten. Mit 10 % Kaliumdichromat oder Kupfer(II)-chlorid als Katalysator kann Ammoniumiodat schon bei Raumtemperatur verbrennen, dabei kann man die Entwicklung von lilafarbenen Ioddampf beobachten.[2]
Sicherheitshinweise
BearbeitenAmmoniumiodat ist ein starkes Oxidationsmittel und kann mit brennbaren Stoffen heftig reagieren.[1]
Einzelnachweise
Bearbeiten- ↑ a b c d e f g Datenblatt Ammonium iodate, 99% bei Alfa Aesar, abgerufen am 11. März 2022 (Seite nicht mehr abrufbar).
- ↑ a b c A. A. Shidlovskiy: COMBUSTION OF THE INORGANIC SALTS AMMONILM IODATE AND HYDROXYLAMINE SULFATE, Zhurnal Prikladnoy Khimii, Vol. 35, No. 3, 1962, S. 511–516.
- ↑ Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S. 604.

