Antimon(III)-sulfat ist das Antimon-Salz der Schwefelsäure.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
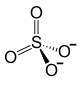
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Antimon(III)-sulfat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | Sb2(SO4)3 | |||||||||||||||
| Kurzbeschreibung |
Farblose, hygroskopische, nadelförmige Kristalle[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 531,71 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Gewinnung und Darstellung
BearbeitenAntimon(III)-sulfat kann durch Reaktion von Antimon(III)-oxid mit heißer, konzentrierter Schwefelsäure hergestellt werden.[1]
Antimon(III)-oxid und Schwefelsäure reagieren zu Antimon(III)-sulfat und Wasser
Reaktionen
BearbeitenAus (basischem) Antimon(III)-sulfat lässt sich durch Kochen mit stark verdünnter Natriumcarbonatlösung wieder das Antimon(III)-oxid herstellen: [4]
Antimon(III)-sulfat reagiert mit Natriumcarbonat und Wasser zu Antimon(III)-oxid, Natriumsulfat und Kohlensäure
Sicherheitshinweise
BearbeitenAntimon und seine Verbindungen sind durch die MAK-Kommission als krebserregend (Kategorie 2) und als keimzellenmutagen (Kategorie 3A) eingestuft werden.[5]
Nachweis
BearbeitenDie Antimon-Kationen des Antimon(III)-sulfats können mit der Marshschen Probe nachgewiesen werden.
Die Sulfat-Anionen können mittels des Sulfatnachweises mit einer wässrigen Lösung von Bariumchlorid nachgewiesen werden.
Literatur
Bearbeiten- Georg Brauer: Handbuch der präparativen anorganischen Chemie. 1963.
Einzelnachweise
Bearbeiten- ↑ a b c Georg Brauer: Handbuch der präparativen anorganischen Chemie. 1963.
- ↑ a b c Eintrag zu Antimon(III)-sulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ M. Binnewies, E. Milke: Thermochemical Data of Elements and Compunds. 2. Auflage. Wiley-VCH, Weinheim 2002, ISBN 3-527-30524-6, S. 782.
- ↑ Handwörterbuch der Chemie. Abgerufen am 23. Januar 2011.
- ↑ Ständige Senatskommission zur Prüfung gesundheitsschädlicher Arbeitsstoffe: MAK- und BAT-Werte-Liste 2021. 57. Mitteilung. In: Deutsche Forschungsgemeinschaft (Hrsg.): Maximale Arbeitsplatzkonzentrationen und Biologische Arbeitsstofftoleranzwerte. PUBLISSO, 2021, ISBN 978-3-9822007-1-2, doi:10.34865/mbwl_2021_deu.

![{\displaystyle \mathrm {\ \!\ {\Biggr ]}_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/cd32744e9f4314d390f5ee107a8bd812d0cc2da0)

