Avidin
Avidin ist ein basisches Glykoprotein, das im Eiklar vieler Vogel- und Amphibieneier vorkommt und das Biotin (Vitamin B7) zu einem stöchiometrischen Komplex bindet, der nicht resorbierbar ist. Zusammen mit Lysozym und Conalbumin bildet Avidin ein antibakterielles System im Eiklar einiger Tierarten.[1] Im Hühnerei macht es etwa 0,05 Prozent des Eiklar-Proteins aus.[2][3] Es handelt sich bei Avidin um ein tetrameres Protein, welches vier Biotin-Moleküle binden kann. Dies führt unter anderem dazu, dass Biotin im Gastrointestinaltrakt nicht aufgenommen werden kann, wenn man viel rohes Ei isst. Avidin vermindert sowohl die Verfügbarkeit des mit der Nahrung zugeführten, als auch des von der Darmflora produzierten Biotins. Damit kann experimentell durch Zusatz von Avidin oder rohem Eiklar zur normalen Kost Biotinmangel erzeugt werden.[4] Beim Erhitzen wird Avidin denaturiert und damit inaktiviert.[1]
| Avidin (Gallus gallus) | ||
|---|---|---|
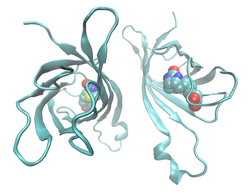
| ||
| Bändermodell eines Avidin-Dimer, mit gebundenem Biotin als Kalotten, nach PDB 1AVD | ||
|
Vorhandene Strukturdaten: s. UniProt | ||
| Masse/Länge Primärstruktur | 128 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homotetramer | |
| Bezeichner | ||
| Gen-Name(n) | AVD | |
| Externe IDs | ||
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
Struktur
BearbeitenDie Primärstruktur des Monomers, also jeder der vier identischen Untereinheiten besteht aus 128 Aminosäuren, das Tetramer hat eine Gesamt-Molekülmasse von 66 kDa.[5]
Homologe
BearbeitenStreptavidin ist ein bakterielles Avidin aus Streptomyces, welches ebenfalls Biotin bindet, wenn auch geringfügig schwächer als das Avidin. Weil das bakterielle Streptavidin jedoch kein Glykoprotein ist und es daher geringere unspezifische Bindungen aufweist, wird es in der Biochemie bevorzugt eingesetzt. Neutravidin ist eine deglykosylierte Form des Avidins.
Entdeckung
Bearbeiten1940 hatte man beobachtet, dass Küken, die rohes Eiklar erhielten, unter Biotinmangel litten. Im selben Jahr gelang es Esmond Emerson Snell als erstem, das entsprechende Protein zu isolieren. Er benannte es Avidin nach der Eigenschaft, sich "gierig" (engl. "avid") mit Biotin zu verbinden.[6]
Grüne Biotechnologie
BearbeitenMit dem Avidin-Mais wurde über die Grüne Gentechnik ein transgener Mais entwickelt, der in der Lage ist, Avidin in Konzentrationen über 100 ppm zu exprimieren. Dieses schützt den Mais aufgrund der Biotin-Bindung vor allem bei der Lagerung gegen Schädlingsbefall, da der hervorgerufene Biotinmangel für Schadinsekten toxisch ist. Für Mäuse, die 21 Tage mit dem Mais gefüttert wurden, war dieser nicht giftig.[7] Auf diese Weise sollen Ernteausfälle durch Insektenbefall während der Lagerung vor allem in tropischen Ländern reduziert werden. Zudem wurden Experimente durchgeführt, wie Synergieeffekte von Bt- und Avidin-Mais als Insektenschutz genutzt werden können.[8]
Weblinks
Bearbeiten- RCSB Protein Data Bank: 1VYO Structure Summary (Molekül-Visualisierung)
Einzelnachweise
Bearbeiten- ↑ a b Avidin im Lexikon der Biochemie, Spektrum.de, abgerufen am 15. Mai 2022.
- ↑ UniProt P02701
- ↑ David L. Nelson, Michael M. Cox, Albert L Lehninger: Principles of Biochemistry. 5. Auflage. W.H. Freeman, New York 2008, ISBN 978-0-7167-7108-1.
- ↑ Gerald Rimbach, Jennifer Nagursky, Helmut F. Erbersdobler: Lebensmittel-Warenkunde für Einsteiger. Springer-Verlag, 2015, ISBN 978-3-662-46280-5, S. 59 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ invitrogen: Molecular probes : Handbook of fluorescent probes and research chemicals. 7. Auflage. Eugene, Or., Molecular Probes, 1999, ISBN 0-9652240-5-8 Seite zu Avidin
- ↑ Nicole Kresge, Robert D. Simoni, Robert L. Hill: The Discovery of Avidin by Esmond E. Snell. In: The Journal of Biological Chemistry.
- ↑ K. J. Kramer, T. D. Morgan, J. E. Throne, F. E. Dowell, M. Bailey, J. A. Howard: Transgenic avidin maize is resistant to storage insect pests. In: Nature Biotechnology. 18(6), 2000, S. 670–674. PMID 10835608.
- ↑ Y. C. Zhu, J. J. Adamczyk Jr, S. West: Avidin, a potential biopesticide and synergist to Bacillus thuringiensis toxins against field crop insects. In: Journal of Economic Entomology. 98(5), 2005, S. 1566–1571. PMID 16334325.