bZIP-Domäne
Die bZIP-Domäne, auch Leucin-Zipper genannt, ist eine Proteindomäne, die sich in vielen eukaryotischen DNA-Bindeproteinen befindet und der Dimerisierung von Proteinen dient. Die Abkürzung steht für Basic Leucine Zipper Domain, da ein Teil dieser Region viele basische Aminosäuren, wie Lysin und Arginin, enthält.
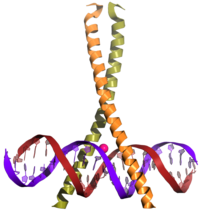
Eine bZIP-Domäne besteht aus einer α-Helix, bei der jede erste und vierte aus sieben Aminosäure – oftmals eben ein Leucin – hydrophob ist. Dies wird oft auch als Heptadenmuster bezeichnet.
Kommen zwei dieser Domänen aus zwei Proteinen in Kontakt, können sich sowohl Homo- als auch Hetero-Dimere bilden. Die Leucine lagern sich in der hydrophilen Umgebung aufgrund hydrophober Wechselwirkungen zusammen. Da die jeweils nachfolgenden Leucine nicht 100%ig in einer geraden Linie stehen, winden sich die beiden Alpha-Helices zu einer linksgängigen Super-Helix (engl. Coiled-Coil). An der DNA-Binderegion stoppt die Verwindung und bildet eine Gabel, die Superhelixarme stehen etwas auseinander, sodass die hier häufig anzutreffenden positiv geladenen Aminosäuren Arginin und Lysin an das negativ geladene Phosphat-Rückgrat der DNA binden.
Proteine mit bZIP-Domäne
BearbeitenLiteratur
Bearbeiten- William H. Landschulz, Peter F. Johnson, Steven L. McKnight: The leucine zipper: a hypothetical structure common to a new class of DNA-binding proteins. In: Science. Bd. 240, Nr. 4860, 1988, S. 1759–1764, doi:10.1126/science.3289117, PMID 3289117.