Bariumiodid ist das Bariumsalz der Iodwasserstoffsäure.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| _ Ba2+ _ I− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Bariumiodid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | BaI2 | |||||||||||||||
| Kurzbeschreibung |
farb- und geruchlose hygroskopische Kristalle[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | ||||||||||||||||
| Aggregatzustand |
fest[3] | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
Zersetzung[5] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−602,1 kJ/mol[8] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Herstellung
BearbeitenBariumiodid kann durch Reaktion von Bariumcarbonat mit Iodwasserstoff dargestellt werden.[6]
Ebenso kann es aus Bariumhydroxid und Iod in Gegenwart eines Reduktionsmittels, z. B. Phosphor oder Schweflige Säure hergestellt werden.[6]
Möglich ist auch die Herstellung durch Reaktion von Bariumhydrid mit Ammoniumiodid in Pyridin.[9]
Eigenschaften
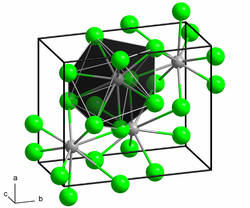
BearbeitenBariumiodid kristallisiert im PbCl2-Typ (Pnma, a = 892,2(8) pm, b = 530,4(4) pm, c = 1069,5(8) pm und Z = 4) in dem jedes Bariumkation von neun Iodidanionen umgeben ist.[10] Bariumiodid bildet hygroskopische Kristalle[2] und tritt häufig als Dihydrat BaI2 · 2 H2O auf. Das Dihydrat gibt bei 150 °C sein Kristallwasser ab.[5] Es ist sehr gut wasserlöslich, die Löslichkeit nimmt mit steigender Temperatur zu.[6] Aus der wässrigen Lösung fällt bei Zugabe von Sulfationen ein weißer Niederschlag von Bariumsulfat aus.
Verwendung
BearbeitenBariumiodid wird unter den Namen Barium iodatum und Baryta jodata in der Homöopathie angewendet.[1]
Einzelnachweise
Bearbeiten- ↑ a b E. Nürnberg, P. Surmann: Methoden. (eingeschränkte Vorschau in der Google-Buchsuche)
- ↑ a b c Datenblatt Barium iodide, anhydrous (PDF) bei Strem, abgerufen am 25. Dezember 2012.
- ↑ a b c Eintrag zu Bariumiodid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ a b Datenblatt Bariumiodid bei Sigma-Aldrich, abgerufen am 12. Oktober 2023 (PDF).
- ↑ a b c Dale L. Perry, Sidney L. Phillips: Handbook of Inorganic Compounds. CRC Press, 1995, ISBN 978-0-8493-8671-8, S. 223 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c d e R. Abegg, F. Auerbach: Handbuch der anorganischen Chemie. Bd. 2, Verlag S. Hirzel, 1908. S. 256ff. (Volltext).
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag barium salts, with the exception of barium sulphate, salts of 1-azo-2-hydroxynaphthalenyl aryl sulphonic acid, and of salts specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-6.
- ↑ Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 923.
- ↑ E. B. Brackett, Th. E. Brackett, R. L. Sass, J. Phys. Chem. 1963, 67, 2132-2135. doi:10.1021/j100804a038.
