Bariumstannat
Bariumstannat ist eine anorganische chemische Verbindung des Bariums aus der Gruppe der Stannate. Es existieren mit BaSnO3, Ba3Sn2O7 und Ba2SnO4 drei Oxostannat-(IV)-Verbindungen im BaO-SnO2-Binärsystem, aber als Bariumstannat wird normalerweise BaSnO3 bezeichnet, weil unter diesen BaSnO3 die bekannteste, die am besten untersuchte und die nützlichste Verbindung ist.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
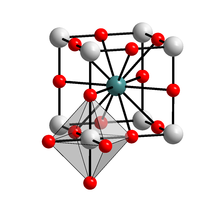
| ||||||||||||||||
| _ Ba2+ _ Sn4+ _ O2− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Bariumstannat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | BaSnO3 | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 304,04 g·mol−1 | |||||||||||||||
| Dichte |
7,24 g·cm−3[1] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Gewinnung und Darstellung
BearbeitenBariumstannat kann durch Reaktion von Zinn(IV)-oxidhydrat mit Bariumhydroxid bei 250 °C oder durch Reaktion von Bariumcarbonat mit Zinn(IV)-oxid bei 1200 bis 1400 °C gewonnen werden.[4]
Ebenfalls möglich ist die Darstellung durch Reaktion von Bariumcarbonat mit Zinn(IV)-chlorid oder Zinn(IV)-oxid mit Bariumnitrat.[4]
Eigenschaften
BearbeitenBariumstannat und sein Trihydrat sind weiße Feststoffe, die schwer löslich in Wasser sind.[1] Er ist ein halbleitendes Oxid mit einer großen Bandlücke von mehr als 3,1 eV.[4] Er besitzt eine kubische Kristallstruktur mit der Raumgruppe Pm3m (Raumgruppen-Nr. 221).[5]
Verwendung
BearbeitenBariumstannat wird zur Herstellung von speziellen Keramikisolierungen, die dielektrischen Eigenschaften erfordern, eingesetzt.[1]
Einzelnachweise
Bearbeiten- ↑ a b c d e f Dale L. Perry: Handbook of Inorganic Compounds. CRC Press, 2016, ISBN 978-1-4398-1462-8, S. 487 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Eintrag zu Bariumsalze in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. Dezember 2024. (JavaScript erforderlich)
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag barium salts, with the exception of barium sulphate, salts of 1-azo-2-hydroxynaphthalenyl aryl sulphonic acid, and of salts specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 29. Dezember 2024. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b c Wensheng Lu, Helmut Schmidt: Hydrothermal synthesis of nanocrystalline BaSnO3 using a SnO2-xH2O sol. In: Journal of the European Ceramic Society. 25, 2005, S. 919, doi:10.1016/j.jeurceramsoc.2004.04.010.
- ↑ Ku Noor Dhaniah Ku Muhsen, Rozana Aina Maulat Osman, Mohd Sobri Idris: Giant anomalous dielectric behaviour of BaSnO3 at high temperature. In: Journal of Materials Science: Materials in Electronics. , doi:10.1007/s10854-019-01065-x.
