| Carbonsäureester |
|---|
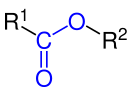
Die funktionelle Gruppe ist blau markiert. |
Carbonsäureester (R1–CO–O–R2) sind Ester, die formal aus einer Carbonsäure (R1–COOH) und einem Alkohol bzw.Phenol (R2-OH) zusammengesetzt sind. Ester kurzkettiger Monocarbonsäuren kommen als wohlriechende Verbindungen in ätherischen Ölen (sogn. Fruchtester) und jene längerkettiger Monocarbonsäuren in natürlichen Wachsen vor.
Pflanzliche und tierische Fette und fette Öle sind dreifache Ester (Triglyceride) der Fettsäuren und des dreiwertigen Alkohols Glycerin. Viele Polyester sind polymere Carbonsäureester der Dicarbonsäuren und Diole und haben als Kunststoffe wichtige Bedeutung. Der Carbonsäureester Essigsäureethylester ist ein häufig benutztes Lösungsmittel.
Nomenklatur und Strukturerklärung
BearbeitenCarbonsäureester setzen sich aus einem Carbonsäureteil und einem Alkoholteil zusammen. Bei Trivialnamen der Carbonsäureester wird der Name oft aus dem Namen der Carbonsäure und der Bezeichnung für den organischen Rests des Alkohols, sowie aus dem Wort Ester zusammengesetzt. Ein Beispiel istEssigsäureethylester, dessen Name sich aus Essigsäure, dem Alkylrest des Alkohols Ethanol (ethyl-) und dem Wort Ester bildet.
Der systematische Name dieses Esters ist jedoch Ethylethanoat und wird nach dem Prinzip „Rest des Alkohols (= Ethyl) + Grundkörper der Säure (= Ethan) + oat“ gebildet. Das Suffix "R-oat" ist jedoch nicht bei allen Verbindungen zulässig. Befindet sich in einer Verbindung eine weitere funktionelle Gruppe mit höherer Priorität, wie zum Beispiel eine Säure oder ein Kation, dann muss der Ester als Präfix genannt werden. Die zu verwendende Bezeichnung lautet R-oxycarbonyl-.
Beispiele
Bearbeiten| Säure | Alkohol | Ester |
|---|---|---|
| einfache Carbonsäureester am Beispiel der Essigsäure | ||
| Essigsäure |
Methanol |
Essigsäuremethylester |
| Ethanol |
Essigsäureethylester | |
| 1-Butanol |
Essigsäurebutylester | |
| Lactone: innere Carbonsäureester | ||
| 4-Hydroxybutansäure |
γ-Butyrolacton | |
| Fette und fette Öle | ||
| als Beispiel: Hexansäure (allg.: → Fettsäuren) |
Glycerin |
Triglyceride |
| Polyester: z. B. PET | ||
| Terephthalsäure |
Ethylenglycol |
Polyethylenterephthalat |
Physikalische Eigenschaften
BearbeitenAufgrund der Elektronegativitätsdifferenz zwischen Kohlenstoff und Sauerstoff ist die Carbonsäureester-Gruppe polar und ermöglicht im Prinzip eine Löslichkeit in Wasser durch Bildung von Wasserstoffbrückenbindungen. Vom kurzkettigen Carbonsäureester Essigsäuremethylesterlösen sich etwa 250 g/l in Wasser. Von dem etwas langkettigeren Essigsäurebutylester gehen nur noch ca. 10 g/l in Lösung. Die Gesamtlöslichkeit wird durch die organischen Reste bestimmt, sodass bei hinreichend unpolaren Resten die Wasserlöslichkeit sehr gering wird. Die meisten Ester sindhydrophob und sind Öle oder Wachse.
Die Siedepunkte von kurzkettigen Carbonsäureestern liegen im Vergleich zu Alkoholen oder Carbonsäuren von vergleichbarer molarer Masse wesentlich niedriger, da sie anders als Carbonsäuren oder Alkohole keine starken Wasserstoffbrückenbindungen ausbilden können.
Reaktionen
BearbeitenSynthese
BearbeitenAlkohole und Carbonsäuren lassen sich durch Veresterung zu Carbonsäureestern umsetzen. Die Veresterung erfolgt durch eine Säure als Katalysator und ist eineGleichgewichtsreaktion. Durch Entfernung des entstehenden Wassers aus dem Reaktionsgemisch z.B. durch eine azeotrope Destillation oder durch Einsatz eines Molekularsiebs wird das Gleichgewicht Richtung Ester verschoben.
Neben der Umsetzung von Carbonsäuren führen auch Reaktionen der entsprechenden Carbonsäureanhydride und Carbonsäurechloride zu Estern. Eine weitere, technisch bedeutende Reaktion ist die Umesterung, der Austausch eines Alkohols im Ester gegen einen anderen. Dies wird beispielsweise eingesetzt, um aus Rapsöl die Methylester der Fettsäuren herzustellen, die als Biodiesel verwendet werden.
Esterspaltung
BearbeitenEster können hydrolytisch und pyrolytisch gespalten werden. Für die Hydrolyse werden meist Basen aber auch Säureneingesetzt. Bei der Spaltung mit Säuren entstehen entsprechend dem eingesetzten Edukt der Alkohol und die Carbonsäure. Wird der Ester mit Basen gespalten, entstehen der jeweilige Alkohol und das Carboxylat-Anion. Da im Letzteren das für die Rückreaktion nötige, saure Wasserstoffatom fehlt, ist diese Reaktion irreversibel, d. h. nicht umkehrbar. Dies ermöglicht es, mit einem Überschuss eines Eduktes, z. B. des Alkohols, infolge desPrinzips vom kleinsten Zwang nach Henry Le Chatelier eine quantitative (d.h. vollständige) Esterspaltung durchzuführen. Die basische Esterspaltung wird Verseifung genannt.
Durch Verseifung werden aus Fetten und fetten Ölen die Alkalisalze der Fettsäuren, also die Seifen, gewonnen. Die Esterspaltung kann auch mitLipasen, einer Enzymgruppe, erfolgen,[1] die bei der Verdauung von Fetten eine wichtige Rolle spielen. Praktische Bedeutung hat die Esterspaltung bei Waschmitteln, die Lipasen enthalten, um die wasserunlöslichen Fettreste auf Textilien unter Bildung leidlich wasserlöslicher Fettsäuren und gut wasserlöslichen Glycerins zu spalten. Zur Gewinnung enantiomerenreiner Carbonsäuren oder Alkohole wird in der Chemie stereoselektiv ein Enantiomer racemischer Carbonsäureester gespalten. Dabei bleibt das zweite Enantiomer des Carbonsäureesters unverändert und erlaubt eine Racemat-Trennung.
C,H-Acidität
BearbeitenEster sind keine Säuren, jedoch C,H-acide Verbindungen, da das Proton in α-Position durch sehr starke Basen abgespalten (abstrahiert) werden kann. Hierdurch entsteht ein mesomeriestabilisiertes Enolat:
(R1= H, Organylrest, wie z. B. ein Alkyl- oder Arylrest; R2= Organylrest, wie z. B. ein Alkyl- oder Arylrest).
Säureteil versus Alkoholteil
BearbeitenWie abgebildet, stammt bei der (oft üblichen) Bildung des Esters aus Carbonsäure und Alkohol der blau dargestellte Teil des Esters aus dem Alkohol (hier: Ethanol) und der rot dargestellte Teil aus der Carbonsäure (hier:Essigsäure). Eine Ausnahme ist die Bildung der Ester aus Salzen der Carbonsäure (Carboxylaten) und Alkylierungsmitteln; hierbei stammt der im Bild blau dargestellte Sauerstoff aus der Carbonsäure.
Bei der Spaltung von Estern (sowohl sauer als auch basisch katalysierbar) enthält der dabei gebildete Alkohol den im Bild blau dargestellten Sauerstoff. Auch hier gibt es eine Ausnahme, nämlich die sauer katalysierte Spaltung von Estern tertiärer Alkohole, bei denen aus dem Alkohol-Teil einAlken gebildet wird (E1-Reaktion).
Dass das bei der Esterbildung verbleibende Sauerstoffatom aus dem Alkohol stammt, ist durch Isotopenmarkierung unter Verwendung des Sauerstoffisotops18O belegbar.[2]
Weitere Reaktionen
Bearbeiten- Arylester können mittels Fries-Umlagerung zu Arylketonen reagieren.
- Spezielle Ester könne eine Chan-Umlagerung eingehen.
- Umwandlung in Isocyanate mittels Lossen-Abbau.
Einzelnachweise
Bearbeiten- ↑ Maryadele J. O'Neil (Hrsg.): The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, Merck, Whitehouse Station 2006, ISBN 978-0-911910-00-1, S. 955.
- ↑ Ivan Ernest: Bindung, Struktur und Reaktionsmechanismen in der organischen Chemie. Springer, Wien/New York 1972,ISBN 3-211-81060-9, S. 73−74.