Cheyne-Stokes-Atmung
Bei der Cheyne-Stokes-Atmung – benannt nach John Cheyne (1777–1836) und William Stokes (1804–1878) – handelt es sich um eine pathologische Atmungsform. Sie ist durch ein periodisches An- und Abschwellen der Atemtiefe und des Abstands der einzelnen Atemzüge voneinander charakterisiert. An die flachsten Atemzüge schließt sich oft ein kürzerer Atemstillstand an, dann setzen wieder Atemzüge ein, die sich zunehmend vertiefen.
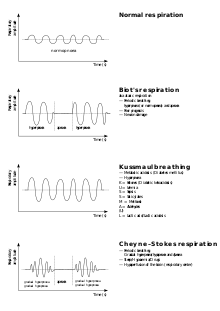
Eine Cheyne-Stokes-Atmung findet man häufig bei ungenügender Hirndurchblutung, beispielsweise durch Gefäßsklerose, bei Schlaganfällen oder Vergiftungen. Auch bei Tieren im Winterschlaf wurde die Cheyne-Stokes-Atmung beobachtet.[1]
Klinik
BearbeitenDie Cheyne-Stokes-Atmung, eine besonders schwere Form von schlafbezogenen Atmungsstörungen (SBAS), ist assoziiert mit schweren Formen der Herzinsuffizienz. So liegt die Prävalenz der Cheyne-Stokes-Atmung bei diesen Patienten bei 30–40 %.[2] Bei der Cheyne-Stokes-Atmung kommt es zu einem periodisch wiederkehrenden An- und Abschwellen der Atmung: Die Atemzüge werden immer flacher, bis sie nach einer Atempause von manchmal mehr als zehn Sekunden wieder tiefer bis hin zu angestrengten Atemzügen werden. Zusätzlich kann sich dabei auch die Atemfrequenz verändern.
Eine Cheyne-Stokes-Atmung tritt nachts bei Patienten mit fortgeschrittener Herzinsuffizienz häufig auf (zentrales Schlafapnoe-Syndrom), sowie bei weiteren Schädigungen des Zentralnervensystems, beispielsweise bei einer Urämie oder exogenen Vergiftung sowie bei Überdosierungen von Opioiden wie Polamidon (Methadon). Die Cheyne-Stokes-Atmung kann ein Vorstadium der präterminalen Schnappatmung sein, andererseits auch ohne Krankheitsbedeutung während des normalen Schlafs vorkommen. In der Höhe über 3000 m tritt sie häufig vor allem im Schlaf auf und wird periodische Atmung genannt. Durch die höhenbedingte Hyperventilation kommt es über die respiratorische Alkalose zu einer relativen Hemmung des Atemzentrums in der Medulla oblongata, die Atemaussetzer betragen 10 Sekunden bis zu einer Minute. Durch den Anstieg des CO2 werden über den Glomus caroticum wieder tiefe Atemzüge initiiert, welche wiederum die respiratorische Alkalose verstärken, so dass sich dieses Phänomen selbst erhält. Die periodische Atmung gilt nicht als Symptom der Höhenkrankheit und sie tritt auch nach erfolgreicher Akklimatisation häufig weiter auf, kann aber Schlaf und nächtliche Erholung stören.
Pathophysiologie
BearbeitenUrsächlich ist eine nichtlineare Sensitivität des Atemzentrums auf den CO2-Partialdruck im arteriellen Blut. Da der ansteigende CO2-Partialdruck im arteriellen Blut als stärkster Atemreiz wirkt, steigen Atemzugtiefe und Atemfrequenz, bis ein niedriger CO2-Gehalt im Blut wieder zu verringerter Atmung und Pausen führt. Der CO₂-Partialdruck beginnt dann wieder anzusteigen, bis der Zyklus von vorn beginnt. Da die Empfindlichkeit auf CO2 bei niedrigen Partialdrücken überproportional geringer und bei hohen Partialdrücken überproportional hoch ist, kommt es zu einem „Schwingen des Atemreglers“.
Ein negativer Einfluss der Cheyne-Stokes-Atmung auf den klinischen Verlauf der Herzinsuffizienz wird diskutiert. Je ausgeprägter die Herzinsuffizienz – und dabei vor allem die linksventrikuläre Komponente – umso ausgeprägter können zentrale und periodische Atemmuster sein.
Therapie
BearbeitenZur Behandlung der Cheyne-Stokes-Atmung kommen als Beatmungsverfahren die antizyklisch modulierte Ventilation (AZMV) bzw. die adaptive Servoventilation (ASV)[3] zur Geltung, welche das früher eingesetzte BiPAP-Verfahren (für bilevel positive airway pressure) abgelöst haben. Dabei wird über ein Maskensystem von Atemzug zu Atemzug eine automatische Regulation des Atemdrucks eingesetzt und das Schwingen der Atemregulation mechanisch gedämpft. Diese Verfahren haben gegenüber der klassischen CPAP-Beatmung verschiedene Vorteile: Sie gleichen Atemschwankungen aufgrund der Cheyne-Stokes-Atmung antizyklisch aus und modulieren die pathophysiologischen Atemmuster in die physiologische Richtung.[4]
Seit der Veröffentlichung erster Ergebnisse der SERVE-HF-Studie, sollte die ASV aufgrund erhöhter Mortalität bei Herzinsuffizienzpatienten mit eingeschränkter linksventrikulärer Ejektionsfraktion allerdings nicht mehr verwendet werden.[5]
In einzelnen Fällen führt eine Gabe von zusätzlichem Sauerstoff (2–4 l/min) zu einer Linearisierung der Atemantwortkurve und somit zu einer medikamentösen Dämpfung der schwingenden Atemregulation.
Im Fall der akuten Höhenkrankheit muss ein sofortiger Abstieg bis zur Besserung aller Beschwerden erfolgen. Dieses ist notwendig, um wieder ausreichende Sauerstoffzufuhr zu gewährleisten.
Siehe auch
BearbeitenEinzelnachweise
Bearbeiten- ↑ W. A. Müller, S. Frings: Tier- und Humanphysiologie. 3. Auflage. Berlin 2006, ISBN 3-540-32728-2, S. 523.
- ↑ O. Oldenburg, A. Lamp, L. Faber, H. Teschler: Sleep-disordered Breathing in patients with symptomatic heart failure. A contemporary study in prevalence and characteristics of 700 patients. In: European Journal of Heart Failure. 2007; 9, S. 251–257.
- ↑ W. Galetke, N. Anduleit u. a.: Evaluation of a new algorithm for patients with cheyne-stokes-breathing and obstructive sleep apnea. Abstract 1560, ERS Congress, Stockholm 2007.
- ↑ M. Bögel (Red.): Schlafbezogene Atmungsstörungen und kardiovaskuläres Risiko. Eine Standortbestimmung. Weinmann Medical Technology, Hamburg 2009.
- ↑ https://dgk.org/daten/ErhoehtesMortalitaetsriskikobeiASV-Therapie_Stellungnahme_DGK.pdf