Chloressigsäure
In Chloressigsäure (auch: Monochloressigsäure) ist ein Wasserstoffatom der Methylgruppe der Essigsäure durch ein Chloratom ersetzt.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
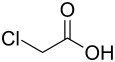
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Chloressigsäure | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C2H3ClO2 | ||||||||||||||||||
| Kurzbeschreibung |
farbloser, stechend riechender Feststoff[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 94,50 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||||||||
| Dichte |
1,58 g·cm−3 (20 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
189 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert |
2,87 (25 °C)[4] | ||||||||||||||||||
| Löslichkeit |
sehr gut in Wasser (4210 g·l−1 bei 20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−509,7 kJ/mol[6] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Darstellung
BearbeitenDie Darstellung erfolgt durch Chlorierung von Essigsäure bei 85 °C und bis zu 6 bar unter Zugabe katalytischer Mengen von Acetanhydrid oder Acetylchlorid.
Eigenschaften
BearbeitenChloressigsäure bildet farblose Kristalle mit stechendem (essigsäureartigem) Geruch, die zwischen 53 und 63 °C schmelzen (je nach Modifikation) und sich leicht in Wasser, aber auch in Ethanol, Diethylether und anderen organischen Lösungsmitteln lösen. Die wässrige Lösung reagiert stark sauer, wesentlich stärker sauer als Essigsäure.
Grund dafür ist die Stabilisierung des Anions durch das recht elektronegative Chloratom: Es wirkt elektronenziehend und verteilt (delokalisiert) die negative Ladung des Anions über das gesamte Molekül und stabilisiert das Anion.
Verwendung
BearbeitenChloressigsäure ist Ausgangsstoff für Carboxymethylcellulose, Mercaptoessigsäure, Cyanessigsäure sowie für Pflanzenschutzmittel, Farbstoffe oder Arzneimittel. Direkt angewendet wird Monochloressigsäure beim Verätzen von Warzen (Handelsname: Acetocaustin).
Die Anwendung von Monochlor- und Monobromessigsäure als Desinfektions- und Konservierungsmittel in der Getränkeindustrie führte 1985 in Bayern zum Bierskandal.[7][8]
Gefahren
BearbeitenChloressigsäure und ihre Dämpfe sind giftig und wirken stark ätzend an den Augen, den Atemwegen und der Haut. Die Substanz wird leicht durch die Haut aufgenommen. Bei Berühren der Haut muss die Säure sofort mit Wasser abgespült werden. Es besteht die Gefahr einer Vergiftung, die bei Benetzung von 5 bis 10 % der Körperoberfläche, ab 80%iger Lösung, zum Tode führen kann.
Siehe auch
BearbeitenEinzelnachweise
Bearbeiten- ↑ Eintrag zu CHLOROACETIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 24. Februar 2020.
- ↑ a b c d e f g h Eintrag zu Chloressigsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ Registrierungsdossier zu Chloroacetic acid (Abschnitt Vapour pressure) bei der Europäischen Chemikalienagentur (ECHA), abgerufen am 27. Juli 2016.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Dissociation Constants of Organic Acids and Bases, S. 8-42.
- ↑ Eintrag zu Chloroacetic acid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-21.
- ↑ Kantonales Amt für Lebensmittelkontrolle St.Gallen: 125 Jahre Kantonales Laboratorium, Jubiläumsschrift 1878 - 2003 ( vom 8. Januar 2006 im Internet Archive).
- ↑ Wolfgang Wagemann: Gelöst - Neues Desinfektionsmittel für CIP-Anwendungen. In: Brauindustrie, 2000 (11), S. 638–640.


