Cunean
Cunean ist ein gesättigter polycyclischer Kohlenwasserstoff und ein Valenzisomer von Cyclooctatetraen. Der Name leitet sich vom lateinischen Wort cuneus (Keil) ab.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
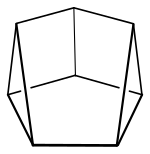
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Cunean | ||||||||||||
| Andere Namen |
Pentacyclo[3.3.0.02,4.03,7.06,8]octan (IUPAC) | ||||||||||||
| Summenformel | C8H8 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 104,15 g·mol−1 | ||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Nach Cuban (Erstssynthese 1964) ist Cunean der zweite von drei möglichen gesättigten C8H8-Kohlenwasserstoffen, der synthetisiert wurde. Die Erstsynthese der Verbindung wurde 1970 veröffentlicht,[1] ein substituiertes Derivat, das Octamethylcunean, wurde bereits 1968 beschrieben.[3] Erst 1988 erfolgte die Synthese des dritten gesättigten C8H8-Kohlenwasserstoffs Octabisvalen.[4]
Herstellung
BearbeitenCunean kann durch eine von Metallionen katalysierte Umlagerung aus Cuban hergestellt werden:[1]
Diese Reaktion entspricht der zuvor veröffentlichten Umlagerung von Homocuban (C9H10)[5] zu Homocunean[6] und Basketan (C10H12) zu Snoutan.[7][8]
Eigenschaften
BearbeitenBei 180 bis 200 °C wird Cunean über Semibullvalen als Zwischenstufe zu Cyclooctatetraen isomerisiert:[9]
Molekulare Geometrie
BearbeitenDie Kohlenstoffe des Cuneans bilden einen Hexaeder mit der Punktgruppe C2v. Auf Grund der Symmetrie existieren 3 Gruppen äquivalenter Kohlenstoffatome (A, B, C), welche durch NMR-Spektroskopie nachgewiesen werden konnten.[10][11]
Derivate
BearbeitenEinige Cuneanderivate haben flüssigkristalline Eigenschaften.[12] Weiterhin existieren auch Koordinationsverbindungen, die die Geometrie des Cuneans aufweisen, jedoch statt der CH-Gruppen Metallatome wie Nickel auf den Ecken des Hexagons tragen.[13]
Einzelnachweise
Bearbeiten- ↑ a b c d Philip E. Eaton, Luigi. Cassar, Jack. Halpern: Silver(I)- and palladium(II)-catalyzed isomerizations of cubane. Synthesis and characterization of cuneane. In: Journal of the American Chemical Society. Band 92, Nr. 21, Oktober 1970, S. 6366–6368, doi:10.1021/ja00724a061.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ R. Criegee, R. Askani: Octamethyl-semibullvalen. In: Angewandte Chemie. Band 80, Nr. 13, Juli 1968, S. 531, doi:10.1002/ange.19680801304.
- ↑ Christoph Ruecker, Bjoern Trupp: Pentacyclo[5.1.0.02,4.03,5.06,8]octane (octabisvalene). In: Journal of the American Chemical Society. Band 110, Nr. 14, 1988, S. 4828–4829, doi:10.1021/ja00222a051.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Homocuban: CAS-Nr.: 452-61-9, PubChem: 136294, ChemSpider: 120068, Wikidata: Q82945203.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Homocunean: CAS-Nr.: 13084-56-5, PubChem: 139382, ChemSpider: 122909, Wikidata: Q82901551.
- ↑ Leo A. Paquette, John C. Stowell: Silver ion catalyzed rearrangements of strained σ bonds. Application to the homocubyl and 1,1′-bishomocubyl systems. In: Journal of the American Chemical Society. Band 92, Nr. 8, April 1970, S. 2584–2586, doi:10.1021/ja00711a082.
- ↑ W.G. Dauben, M.G. Buzzolini, C.H. Schallhorn, D.L. Whalen, K.J. Palmer: Thermal and silver ion catalyzed isomerization of the 1,1′-bishomocubane system: preparation of a new C10H10isomer. In: Tetrahedron Letters. Band 11, Nr. 10, Januar 1970, S. 787–790, doi:10.1016/S0040-4039(01)97830-X.
- ↑ Karin Hassenrück, Hans-Dieter Martin, Robin Walsh: Thermal Behaviour of C8H8 Hydrocarbons Gas-Phase Thermolysis of Cuneane, a New Example of a High-Strain Energy Release Process. In: Chemische Berichte. Band 121, Nr. 2, Februar 1988, S. 369, doi:10.1002/cber.19881210225.
- ↑ Harald Günther, Wolfgang Herrig: Anwendungen der 13C-Resonanz-Spektroskopie, X.13C,13C-Kopplungskonstanten in Methylencycloalkanen. In: Chemische Berichte. Band 106, Nr. 12, Dezember 1973, S. 3938–3950, doi:10.1002/cber.19731061217.
- ↑ M. I. Trofimov, E. A. Smolenskii: Electronegativity of atoms of ring-containing molecules—NMR spectroscopy data correlations: a description within the framework of topological index approach. In: Russian Chemical Bulletin. Band 49, Nr. 3, März 2000, S. 402–407, doi:10.1007/BF02494766.
- ↑ Gyula Bényei, István Jalsovszky, Dietrich Demus, Krishna Prasad, Shankar Rao: First liquid crystalline cuneane‐caged derivatives: a structure–property relationship study. In: Liquid Crystals. Band 33, Nr. 6, Juni 2006, S. 689–696, doi:10.1080/02678290600722940.
- ↑ Andrew Stephenson, Michael D. Ward: An octanuclear coordination cage with a ‘cuneane’ core—a topological isomer of a cubic cage. In: Dalton Transactions. Band 40, Nr. 31, 2011, S. 7824, doi:10.1039/c0dt01767a.