Diethylaluminiumchlorid
Diethylaluminiumchlorid ist eine aluminiumorganische Verbindung. Sie wird als Katalysator zur Herstellung chemischer Produkte verwendet.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
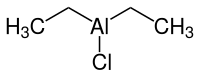
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Diethylaluminiumchlorid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C4H10AlCl | |||||||||||||||
| Kurzbeschreibung |
farb- und geruchlose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 120,56 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
208 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
heftige Zersetzung in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Herstellung
BearbeitenDie Reaktion von zwei Äquivalenten elementarem Aluminium mit drei Äquivalenten eines Alkylhalogenids (RX) ergibt je ein Äquivalent R2AlX und ein Äquivalent RAlX2. Durch Umsetzung von Aluminium mit Ethylchlorid wird so als eines der Produkte Diethylaluminiumchlorid erhalten.[2]
Verwendung
BearbeitenDiethylaluminiumchlorid wird bei Ziegler-Natta Polymerisationprozessen von Vinylen, Alkenen und Dienen sowie linearen Oligomerisationen und Cyclisierungen von ungesättigten Kohlenwasserstoffen als Katalysator eingesetzt. Es wird außerdem als Katalysator bei Alkylierungen benutzt (siehe auch Friedel-Crafts-Alkylierung). Weiterhin dient es als Zwischenprodukt zur Produktion anderer Chemikalien.[3]
Sicherheitshinweise
BearbeitenAls aluminiumorganische Verbindung mit kurzkettigen Alkylresten ist Diethylaluminiumchlorid pyrophor, entzündet sich also bei Kontakt mit Luft schon bei Raumtemperatur spontan. Auch Lösungen – als Lösungsmittel werden Kohlenwasserstoffe verwendet – können sich spontan entzünden, wenn diese nicht stark verdünnt sind. Daneben reagiert die Verbindung auch sehr heftig mit Wasser und verursacht bei Hautkontakt schwere Verätzungen.[4]
Einzelnachweise
Bearbeiten- ↑ a b c d e f g h i Eintrag zu Diethylaluminiumchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ Aristid V. Grosse, Julian M. Mavity: ORGANOALUMINUM COMPOUNDS: I. Methods of Preparation 1. In: The Journal of Organic Chemistry. Band 05, Nr. 2, März 1940, S. 106–121, doi:10.1021/jo01208a004.
- ↑ Hazardous Substance Fact Sheet: Diethylaluminium chloride, Juni 2001.
- ↑ W. B. Heck, R. L. Johnson: ALUMINUM ALKYLS—SAFE HANDLING. In: Industrial & Engineering Chemistry. Band 54, Nr. 12, 1. Dezember 1962, S. 35–38, doi:10.1021/ie50636a007.

